Биотехнологические методы размножения декоративных растений
Развитие цветоводства сдерживают инфекционные болезни, в основном вирусные. Они вызывают потерю декоративных качеств, ухудшение физиологического состояния растений, наносят значительный экономический ущерб.
Особенно страдают от вирусных болезней вегетативно размножаемые цветочные культуры, у которых постоянным источником инфекции служит зараженный посадочный материал (луковицы, клубнелуковицы, корневища, черенки). Вирусные болезни негативно влияют на репродуктивную способность растений, что приводит к фенотипическому изменению признаков сортов, снижению урожая на 40...70 % и вырождению сортов. Особенно подвержены вырождению от вирусной инфекции сорта тюльпана, лилии, нарцисса, гладиолуса, фрезии, хризантемы, георгины.
Среди вирусов, поражающих цветочные растения, имеются неспецифические, способные заражать несколько растений-хозяев. Например, вирус огуречной мозаики поражает не только овощные растения, но и плодовые, бобовые культуры, а также лилию, хризантему, гладиолус, тюльпаны и др. Вирус аспермии томата оказался резерва- тором вирусов хризантемы. Вирус желтой мозаики фасоли поражает фрезию, гладиолус, растения семейства Бобовые.
Вирусные болезни, обнаруженные на цветочных растениях, передаются с посадочным материалом. При бесконтрольном размножении, особенно с использованием культуры меристемы, интенсивность распространения возбудителей может стать выше, чем в природных фитоценозах. Различные агроприемы (некорневая подкормка микроэлементами, обработка биологически активными веществами, химическая борьба с переносчиками инфекции) могут лишь снизить вредоносность болезней, ограничить скорость распространения возбудителей, но не освободить больные растения от вирусов.
Для борьбы с вирусной инфекцией разработан биотехнологический метод размножения декоративных растений, включающий следующие этапы.
Проверка (тестирование) исходных растений на зараженность вирусной инфекцией. Такая проверка предполагает выявление вирусов и определение степени зараженности сортов и культур. Для тестирования чаще всего используют иммунологические методы, среди которых наиболее перспективным считается иммуноферментный анализ (ИФА), характеризующийся высокой чувствительностью. Метод ИФА основан на получении конъюгатов между иммуноглобулинами антисыворотки и белками высокоочищенных ферментов (фосфотазы, пероксидазы).
В тех случаях, когда отсутствуют специфические антисыворотки для ИФА, применяют метод двойной диффузии в агар-агаре.
Более трудоемким считается индикаторный метод (метод биологической проверки) посредством механической передачи вируса с соком больного растения хризантемы на растения-индикаторы (петуния). Он предусматривает выявление вирусной инфекции в полученных после оздоровления растениях- регенерантах спустя 1,5...2мес после адаптации. Это позволяет обнаружить сохранившуюся (остаточную) концентрацию вирусных частиц.
Проверка растений на вирусы совпадает по времени с первой прищипкой у гвоздики и хризантемы. Для гарантированного получения безвирусного посадочного материала выявленные образцы с низким содержанием вирусных частиц возвращают для повторного оздоровления.
Из оставшихся безвирусных растений создают маточник безвирусного су- пер-суперэлитного и суперэлитного материала.
Получение оздоровленного исходного материала. С этой целью используют метод апикальной меристемы, термо- и химиотерапию.
Метод апикальной меристемы основан на выращивании растений из апикальных зон делящихся клеток точки роста размером 100... 200 мкм. В больном растении вирус распространяется с отставанием от быстрорастущих молодых органов. В молодых недифференцированных тканях концентрация вируса может снижаться вплоть до полного отсутствия.
Верхняя часть точки роста растений, представленная апикальной меристемой, у разных растений имеет средний диаметр до 200 мкм и высоту 20... 150 мкм. В более нижних слоях дифференцирующие клетки образуют прокамбий, дающий начало пучкам проводящей системы. Такая особенность строения апикальной меристемы исключает проникновение в нее вируса путем быстрого транспортирования по проводящей системе.
Вычленение апикальных меристем проводят в специально оборудованном микробиологическом боксе. Для повышения стерильности используют лами- нар-боксы или камеры-боксы. Ростки перед вычленением стерилизуют в 1…6%-ном растворе гипохлорита кальция или гипохлорита натрия или в 0,1%-ном растворе сулемы, затем промывают в стерильной воде.
Меристему, включающую кусочек ткани размером 100...200 мкм, вычленяют обычной тонкой иглой, зажатой в цанговом держателе. После вычленения меристему иглой переносят в пробирку на поверхность питательной среды, затем пробирку закрывают пробкой над пламенем и ставят в штатив.
Растения из меристемы выращивают на питательной среде. Основные ее компоненты — соли макро- и микроэлементов, витамины, органические вещества, регуляторы роста. Минеральный состав питательной среды должен обеспечивать снабжение меристемы необходимыми элементами питания. Среда должна быть достаточно буферной, иначе при культивировании меристемы она будет подкисляться. Для культивирования меристем растений используют среду с минеральной основой Мурасиге и Скуга и ее модификации.
Применение метода апикальной меристемы не обеспечивает полного оздоровления исходного материала от вирусов. Выход безвирусных растений от оздоровления остается низким (до 4 %). Наибольший эффект в оздоровлении цветочных растений от вирусов имеет сочетание метода апикальной меристемы с термо- и химиотерапией. При этом выход растений, оздоровленных от вирусов, достигает 70... 100 %.
Метод термотерапии основан на обработке горячим воздухом вегетирующих цветочных растений в специальных термокамерах с регулируемой температурой. Чем дольше экспозиция и больший прирост растений, тем выше гарантия получения безвирусных верхушек. Оптимальным режимом термотерапии считаются температура 37’С, освещенность на уровне 5000 лк с помощью ламп дневного света, фотопериод в зависимости от культуры 14... 16 ч в сутки при относительной влажности воздуха в термокамере 90%.
Продолжительность термотерапии зависит от состава вирусов и их термостойкости. Если для гвоздики достаточно 10...12 нед. воздействия теплом, то для освобождения хризантем от Б-ви- руса этот период продлевают до 16 нед. Растения хризантемы лучше переносят экстремальные условия тепловой обработки. В то же время цимбидиум, антуриум Андрэ и луковичные культуры аналогичные условия не выдерживают, для них наиболее перспективна термотерапия растений-регенерантов в пробирках.
Высокие температуры положительно влияют на точку роста и процессы морфогенеза гвоздики, хризантемы, фрезии в пробирочных условиях. Термообработка стимулирует адаптацию растений-регенерантов после пересадки из пробирок в субстрат.
Химиотерапия основана на добавлении в питательную среду веществ — ингибиторов вирусов (вироцидов). С увеличением числа синтезированных вироцидов метод химиотерапии для освобождения растений от вирусов применяют все шире.
Высокоэффективно совместное применение химиотерапии и культивирования меристемной ткани у цимбидиума и розы. Применение вирацида под названием «виразол» в концентрации 20 и 50 мг/л обеспечило освобождение цимбидиума от вируса кольцевой пятнистости и розы от комплексной мозаики. При использовании вироцидов иногда обнаруживается их фитотоксичное действие: торможение процессов дифференциации меристематических тканей и пролиферации адвентивных побегов.
Культура ткани и регенерация растений в пробирках. Пробирки с помещенной на среду меристемой переносят в специальную камеру с постоянным световым и влаготемпературным режимом. Обычно для создания такого режима используют помещения, оборудованные люминесцентными лампами с кондиционированием воздуха или специальные световые устройства для выращивания растений из верхушечных меристем.
Продолжительность культивирования меристемной ткани и получения растений-регенерантов зависит от вида растения (1,5...4 мес). У гвоздики и хризантемы нормальные развитые растения-регенеранты формируются за 1,5... 2 мес; у розы — за 4,5; у лилии, гиацинта, гиппеаструма — за З...4мес. У антуриума Андрэ период от начала введения первичной меристемы (экспланта) в пробирочную культуру до получения растений более продолжительный — 8…10 мес.
Выживаемость первичного экспланта на питательной среде зависит от его происхождения и размера. Чем больше размер вычлененной меристемы, тем выше гарантия ее дифференциации.
Продолжительность, техника и стерилизующие средства зависят от конкретных культур. Этиловый спирт (70 %) и гипохлорит (2...3%) дают положительные результаты при стерилизации эксплантов хризантемы, гвоздики, цимбидиума, антуриума с экспозицией до 5... 10 мин. Для луковичных (лилия, гиацинт, гиппеаструм) в 3...4 раза увеличивают экспозицию и концентрацию гипохлорита, а также добавляют нитрат серебра в концентрации 0,08 %.
Условия выращивания (питательные среды, температура, освещенность и продолжительность фотопериода) эксплантов и растений-регенерантов создают индивидуально для каждой культуры. Питательные среды составляют соответственно этапам морфогенеза растений (дифференциация, пролиферация, органогенез). Для каждой культуры должно быть определенное соотношение витаминов, углеводов, фитогормонов. Часто используют питательную среду Мурасиге и Скуга в различных модификациях.
Температуру воздуха в климатических камерах поддерживают в пределах 18...20 °С для луковичных растений; 22...23 °С для гвоздики, хризантемы, розы; 24...25 °С для цимбидиума; 26... 28 °С для антуриума Андрэ. Освещенность — в пределах 2500...5000 лк с фотопериодом 14...16 ч (рис. 19, 20).
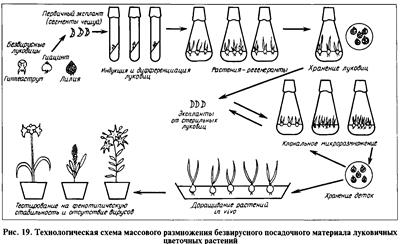
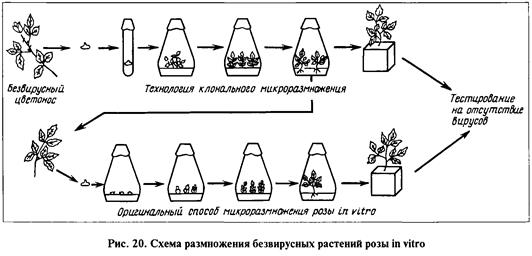
Адаптация растений в стерильном субстрате. Прежде чем растения-регенеранты будут помещены в естественные условия, они должны пройти период адаптации. Для этого растения высаживают в перлит или торфоперлитовую смесь и создают условия, близкие к тем, которые были при выращивании их в пробирках. Через З...4 нед. адаптации растения переносят в изолированную теплицу для доращивания и тестирования на вирусы.
Например, миниатюрные растения хризантемы с хорошо развитой надземной частью (З...4см) и корневой системой пересаживают из пробирок в стерильный субстрат, состоящий из торфа и перлита в соотношении 2:1. Растения проходят период адаптации при температуре 20...22 °С, относительной влажности 70...80 %, освещенности 3000…4000 лк в первые 10 дней и 5000…7000 лк в последующие при фотопериоде 14... 16 ч.
При соблюдении оптимальных условий пересадки и ухода за растениями приживаемость составляет 80...90 %.
Проверка адаптированных растений на вирусы и получение безвирусных растений репродукции М10. Растения, непосредственно выращенные из меристемы, принято обозначать М0, из М0 — M1 и т. д.
Одним из важнейших этапов технологии получения безвирусного посадочного материала является его тщательная проверка. Для своевременного выявления заражения вирусами меристемных растений МО и репродукции Ml проверку осуществляют дважды. Первую проверку МО проводят в период, когда после пересадки из пробирок растения достигают высоты 15 см, что совпадает по времени с первой прищипкой. Зараженные растения выбраковывают, а здоровые пересаживают в более просторные вазоны.
Второе тестирование проводят перед началом размножения.
Создание суперэлитного посадочного материала М1 проверка растений на зараженность вирусной инфекцией. Размноженные растения M1, выращиваемые в качестве безвирусного маточника, также дважды проходят проверку на отсутствие вирусов: первый раз перед снятием черенков, второй — спустя 2…3 мес. после первой проверки.
Черенки с маточных растений МО снимают регулярно по мере их готовности. За сутки перед снятием черенков растения обильно поливают. Недопустимо снимать с маточника все побеги, так как это резко снижает продуктивность растения. Черенки хризантемы укореняются в течение З...4нед, при оптимальных условиях первые корни появляются через 7 дней. Количество укорененных черенков в зависимости от сорта колеблется от 85 до 100 %.
Репродукцию Ml используют для закладки суперэлитного безвирусного маточника и дальнейшего размножения элитного материала.
Создание элитного материала репродукции М2. Массовое размножение безвирусного посадочного материала. Элитным посадочным материалом считается репродукция М2. Приемы и методы выращивания безвирусных маточников не отличаются от выращивания обычных маточников хризантемы, за исключением более жесткого фитосанитарного контроля.
Каждую репродукцию (при выращивании гвоздики и других культур) следует содержать в отдельной теплице. Совершенно недопустимо появление в теплицах тли, белокрылки и трипса, являющихся переносчиками вирусов.
Интенсивное размножение элитного материала в производственных условиях также предусматривает проведение фитосанитарных мероприятий против возможного повторного заражения и распространения вирусов. Соблюдают пространственную изоляцию между посадками элитных маточников и растений, выращиваемых для получения цветов. Химическая борьба с насекомыми — переносчиками вирусов и ежегодная смена участков для борьбы с нематодами повышают декоративность и качество цветочной продукции.
Дата добавления: 2022-01-31; просмотров: 922;
