Химическая связь. Образование связи. Координационная связь.
Мир, в котором мы живем, и мы сами обязаны своим существованием тому, что атомы элементов способны соединяться в молекулы. Существуют соединения, состоящие всего из двух атомов, но есть и такие, в которых соединены тысячи атомов. Из этого небольшого числа кирпичиков мироздания-а насчитывается всего лишь около 100 разновидностей атомов, или элементов,-в ходе естественной эволюции образовались сотни тысяч веществ. Химики же смогли синтезировать еще большее количество новых соединений.
В каждом атоме ядро окружено электронным «облаком», содержащим один или несколько электронов. Поскольку электроны несут отрицательный заряд, электронные облака при сближении атомов отталкиваются друг от друга. Однако если два атома сближаются настолько, что их электронные облака перекрываются, то они начинают притягиваться одновременно обоими положительно заряженными ядрами-возникает химическая связь.

При образовании химической связи часто высвобождается энергия. Водород и кислород соединяются со взрывом, образуя молекулы воды и выделяя большое количество энергии. Поэтому водород крайне огнеопасен, тем не менее в прошлом он использовался для заполнения дирижаблей, что нередко приводило к катастрофам.
Образование связи. Непосредственным результатом этого двойственного процесса притяжения и отталкивания оказывается преобразование орбиталей каждого атома в общую орбиталь. Так возникает химическая связь, и образуется молекула. Электроны, участвующие в образовании химической связи, переходят с прежних атомных орбиталей на общую единую молекулярную орбиталь.
Наиболее распространенной формой химической связи является связь, в которой на одной молекулярной орбитали находятся два электрона, распределенные в пространстве между двумя ядрами. Такая связь называется простой ковалентной связью. Иногда не один, а несколько электронов атома могут участвовать в образовании химической связи. Тогда при соединении двух атомов между ними возникает две (или более) ковалентные связи.
Полностью завершенная электронная оболочка очень устойчива, поэтому атомы различных химических элементов для полного завершения электронной оболочки стремятся заимствовать электроны от других атомов или приобрести электроны в общее владение с ними. Так, если соединяются два атома азота, то, передавая в общее владение по 3 электрона, они тем самым дополняют в образующейся молекуле свои атомные орбитали до полного завершения. В результате ядро каждого из атомов оказывается окруженным в молекуле 8 электронами, а не 5, как это было у изолированного атома.
Атому водорода для полного завершения электронной оболочки недостает 1 электрона, и, следовательно, он может принять только 1 электрон. Если соединяются атом кислорода, имеющий 6 электронов, и 2 атома водорода, то водород образует две простые ковалентные связи с кислородом. В получающейся при этом молекуле воды Н20 атом кислорода имеет две собственные пары электронов и две пары электронов в общем владении с атомами водорода-в итоге он приобретает полностью завершенную восьмиэлектронную оболочку (октет).
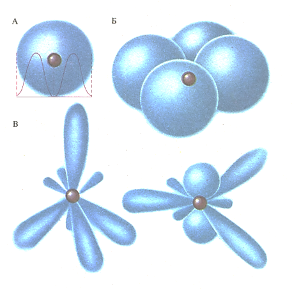
Ядро любого атома окружено электронными облаками. Единственный электрон атома водорода (А) «распределен» в объеме сферического облака. Два неспаренных электрона атома кислорода «распределены» в объеме двух взаимно перпендикулярных гантелевидных электронных облаков (Б). Электронные облака атома углерода при образовании химической связи принимают иную форму (В).
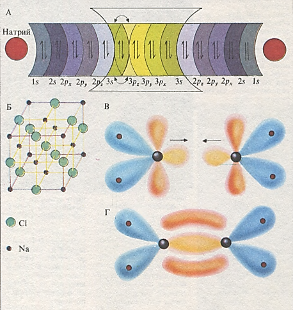
При образовании ионной связи (А) электроны переходят, например, с 3s-орбитали атома натрия (Na) на Зр-орбиталь атома хлора (С1). Ионные соединения обычно обладают строго упорядоченной кристаллической структурой (Б). При образовании ковалентной связи электронное облако окружает одновременно оба ядра, молекулярные орбитали имеют специфическую форму, как, например, в молекуле этилена (В, Г). В образовании этой связи участвуют 4 электрона, остальные электроны атомов углерода связаны с электронами атомов водорода
Ионная связь. Если пара электронов находится в общем владении двух атомов, то говорят о ковалентной связи. Однако одни атомы обладают гораздо большей склонностью к приобретению электронов, чем другие. В результате электроны одного атома полностью переходят на орбитали других атомов, образуя соединения с ионной связью. Образовавшиеся новые атомы уже не являются электрически нейтральными - они несут положительный или отрицательный заряд (в зависимости от того, потеряли они или приобрели электроны). Такие заряженные «атомы» называют ионами. У хлора, имеющего на внешней электронной оболочке 7 электронов, до полного завершения с образованием устойчивого октета недостает только 1 электрона Принимая этот электрон, атом хлора превращается в отрицательно заряженный хлорид-ион С1- . Напротив, у атома натрия на внешней оболочке находится всего 1 электрон, и при его потере легко образуется положительно заряженный ион натрия Na + , у которого «обнажена» внутренняя оболочка, содержащая 8 электронов.
Хлорид натрия, или обычная поваренная соль, служит примером соединения с ионной связью. Если ее растворить в воде, то в раствор переходят как ионы хлора, так и ионы натрия. В растворе эти ионы уже не связаны друг с другом.
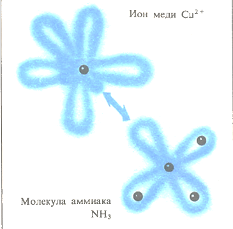
При образовании координационной связи оба электрона, участвующие в связи, предоставляются одним из атомов (одной из молекул). «Свободная» пара электронов аммиака внедряется на пустую незаполненную орбиталь иона меди Си2 + , образуя обычную двухэлектронную связь. Получающееся при это соединение называют координационным. Довольно часто такие вещества ярко окрашены.
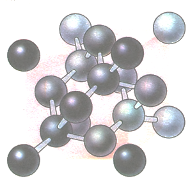
В алмазе каждый из атомов углерода связан 4 ковалентными связями с 4 атомами углерода, расположенными в вершинах тетраэдра. Такая пространственно-ненапряженная конфигурация связей обусловливает высокую твердость алмаза
Координационная связь. Существует и третий достаточно простой способ образования химической связи между атомами. Он подобен ковалентной связи, только в этом случае оба «обобщенных» электрона, участвующие в образовании химической связи, предоставляются лишь одним из атомов. Второй атом, обладавший незаполненной оболочкой, принимает эти электроны,
в результате чего возникает координационная связь. Так, например, у атома азота 5 электронов, 3 из которых могут принимать участие в образовании трех ковалентных связей с атомами водорода. В получающейся при этом молекуле аммиака NH3 атом азота имеет полностью завершенную оболочку, содержащую 8 электронов, в то же время в этой молекуле у атома азота остается два электрона, не участвующие в образовании связей с атомами водорода. Эта свободная пара электронов может занять незаполненную оболочку ионов различных металлов, например ионов меди, с образованием координационной связи. Возникающее при этом вещество относится к комплексным, или координационным, соединениям.
В тех случаях, когда одной парой электронов (общей молекулярной орбиталью) оказываются связаны не два, а больше атомов, образуются более сложные системы. Молекулярные орбитали могут связать между собой несколько ядер, причем на каждую связь будет приходиться в среднем меньше 2 электронов; тем не менее отдельные атомы при этом будут связаны в единую молекулу.
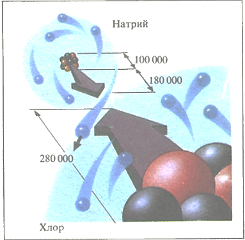
Так выглядел бы ион натрия в кристалле хлорида натрия с ближайшего иона хлора. Один из электронов атома натрия переходит на орбиталь атома хлора. В результате образуются ионы, и между ними возникает ионная связь. Размеры ядра атома натрия, построенного из протонов (красные) и нейтронов, и расстояние между двумя соседними атомами приведены в фемтометрах (1 фм = 10 -15 м)


Энергия, высвобождающаяся при образовании связи, обеспечивает устойчивость молекулы. При поступлении энергии извне возможен обратный процесс. Бесцветные соли серебра используются для изготовления стекол светозащитных очков (А) и в шлемах космонавтов (Б). Под действием солнечного света ионы серебра превращаются в атомы металлического серебра, и стекло, содержащее теперь уже непрозрачный металл, темнеет
Дата добавления: 2022-01-31; просмотров: 774;
