Химические соединения в растворе
Каждый день миллионы людей имеют дело с растворами. Мы встречаемся с ними за завтраком, готовя чай или кофе. Что же происходит с сахаром, когда он растворяется? Почему обычный песок не растворяется, даже если его перемешивать с горячей водой?
На языке химии раствором называют однородную смесь различных видов веществ. Критерий однородности заключается в том, что два или несколько типов частиц, например молекул, тщательно перемешаны между собой. Вода и песок не смешиваются.
О растворении и растворимости. Растворы обычно получают, растворяя твердые вещества в жидкостях-кофе в воде, сахар в растворе кофе, моющие средства в воде и т.д. Однако существуют и другие разновидности растворов. Так, в жидкостях могут растворяться газы-вспомните газированную воду! Многие растворы получают, растворяя одну жидкость в другой. Газы могут растворяться в некоторых твердых веществах. Наконец, твердые вещества также дают растворы, например в сплавах, называемых твердыми.
Для образования раствора необходимо, чтобы происходило взаимодействие растворяемого вещества с растворителем. Так, в сахаре в узлах кристаллической решетки находятся молекулы сахарозы. Чтобы сахар растворился в воде, требуется энергия на разрушение кристаллической решетки. Эта энергия может быть получена только от растворителя. Если растворителем служит вода, то необходимая энергия высвобождается при взаимодействии полярных молекул воды с полярными молекулами сахарозы. Центральный атом кислорода в молекуле воды несет небольшой отрицательный заряд, а атомы водорода - незначительный положительный. Молекулы воды притягиваются друг к другу-именно поэтому вода при комнатной температуре представляет собой жидкость, хотя большинство веществ с малой молекулярной массой газообразно. Молекулы воды способны также притягивать (и переводить тем самым в раствор) другие полярные соединения, например сахар, в молекулах которого имеется много полярных групп ОН.
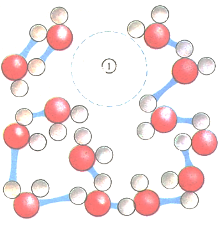
Атомы и молекулы любого вещества находятся в непрерывном движении. В жидкостях движение частиц не дает образоваться какой либо устойчивой межмолекулярной структуре, но благодаря силам притяжения между молекулами жидкость сохраняет свой объем. В воде связи (голубые линии) между отдельными молекулами постоянно разрываются и образуются вновь, поэтому там все время возникают и исчезают небольшие пустоты (1).
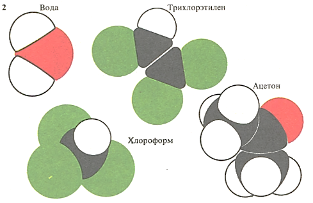
Благодаря полярности, вызванной небольшим положительным зарядом атомов водорода и отрицательным зарядом атомов кислорода вода хорошо растворяет неорганические соли. Трихлорэтилен (используемый при химчистке) растворяет многие органические вещества. По своему строению ацетон занимает промежуточное положение между водой и трихлорэтиленом и растворяет как неорганические, так и органические вещества.
Молекулы и соединения. Подобные, но значительно более слабые силы притяжения возникают в веществах неполярного характера. Поэтому неполярные углеводороды растворяют другие неполярные вещества, например жиры. В современных моющих средствах одновременно действуют оба механизма: одна часть их молекулы (неполярная) активно взаимодействует с малополярными жирами, а другая (полярная)-с водой. В результате молекулы моющих средств действуют как мостики между водой и жировыми загрязнениями, смачивая их и переводя в моющий раствор.
Некоторые соединения, например этиловый спирт, растворяются как в воде, так и в углеводородах-веществах, которые друг в друге не растворяются. Другие соединения-в зависимости от их строения-лучше растворяются либо в полярных, либо в неполярных растворителях.
Если вещество не растворяется в данном растворителе, то это означает, что взаимодействие частиц растворяемого вещества между собой сильнее, чем их взаимодействие с молекулами растворителя. Для большинства веществ существуют определенные пределы растворимости, которые зависят от температуры, причем с повышением температуры растворимость обычно увеличивается.
Раствор, содержащий максимально возможное количество растворенного вещества, называют насыщенным. Горячие жидкости, как правило, лучше удерживают растворенное вещество в растворе, чем холодные. (Для газов, растворенных в жидкостях, справедливо обратное правило.) Если в кипящей воде растворить максимально возможное количество вещества, то при охлаждении раствора часть твердого вещества выпадает из него в виде кристаллов. Если это не происходит, то говорят, что образовался пересыщенный раствор. На кристаллизации веществ из насыщенных растворов основаны многие опыты по выращиванию крупных кристаллов в школьных лабораториях.
Растворение твердого вещества в жидкости заметно влияет на ее свойства. Так, чистая вода замерзает при 0°С и кипит при 100°С. В то же время температура замерзания раствора поваренной соли ниже 0°С, поэтому зимой на улицах часто разбрасывают соль, чтобы предотвратить оледенение.
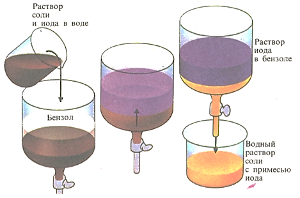
Растворимость вещества в различных растворителях неодинакова. Если в закрытом сосуде встряхивать два несмешивающихся растворителя, то растворенные вещества распределяются между ними. Так, если водный раствор, содержащий одновременно йод и соль, встряхивать с бензолом, то йод в основном перейдет в бензол, а соль останется в воде. Таким способом удается разделить смесь этих двух веществ.
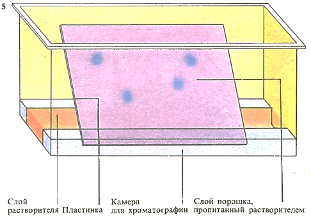
Некоторые вещества можно разделить, используя метод тонкослойной хроматографии. Капля раствора смеси веществ наносится на пластинку, покрытую слоем порошкообразного адсорбента. Пластинку помещаю в камеру, на дно которой налит растворитель. По мере того как растворитель поднимается по пластине, смачивая слой адсорбента, происходит разделение смеси веществ на отдельные компоненты.
Осмотическое давление. Одним из важнейших свойств растворов является их способность вызывать осмотическое давление. Если в одну половину сосуда, разделенного мембраной из некоторых материалов на две половины, налить раствор, а в другую-чистую воду, то молекулы воды начнут проникать сквозь мембрану в раствор, разбавляя его. Молекулы же растворенного вещества не могут пройти сквозь мембрану, поэтому ее называют полупроницаемой.
Осмос имеет решающее значение для существования многих живых организмов. Так, от него зависит засасывание почвенной влаги корневыми волосками растений. Если концентрация растворенных веществ в клетках растений выше, чем в грунтовых водах, то вода начинает проникать сквозь стенки внутрь клетки. Справедливо и обратное положение-на сильно засоленных почвах влага не только не поступает в растение, но и удаляется из него, и растение погибает.
В организмах растений и животных вырабатываются вещества, образующие так называемые коллоидные растворы — нечто среднее между истинными растворами и взвесями (эмульсиями и суспензиями). Примером одного типа коллоидных систем служит кисель, примером другого типа-густая паста краски в тюбиках. Кисель или желе становятся упругими или более жесткими при охлаждении и разжижаются при нагревании. Паста краски разжижается при растирании и загустевает, если оставить ее в покое. Различия в их поведении связаны с тем, что это разные типы коллоидных систем.
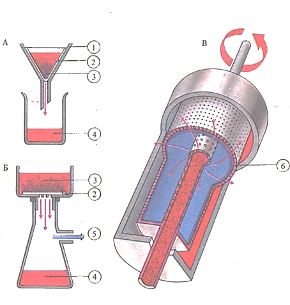
При фильтровании жидкость наливают (А) в воронку (1), где она под действием силы тяжести просачивается через бумажный фильтр (2). Твердые частицы в виде осадка (3) накапливаются на фильтре, а фильтрат (4) собирается в стакане. В воронке Бюхнера (Б) фильтрование ускоряется благодаря разрежению в приемнике для фильтрата (5). В промышленных ротационных фильтрах (В) под действием центробежной силы жидкость продавливается сквозь мельчайшие отверстия сетчатого фильтра (6).
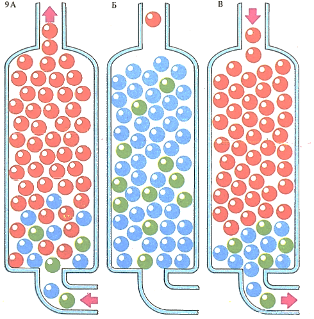
В бытовых водоумягчителях ПОТОК воды поступает в колонку, где ионы кальция (синие) и магния (зеленые), обусловливающие «жесткость» воды, обмениваются на ионы натрия (оранжевые)
Дата добавления: 2022-01-31; просмотров: 673;
