О строении атомов, что такое элементы
Красители, лекарства, синтетические волокна, фотоматериалы, моющие средства, удобрения-все это лишь небольшая часть того разнообразия продукции, которая производится с помощью химии. Но что такое химия? Каждая наука рассматривает мир со своей специфической стороны: основными «кирпичиками» мира для химии являются атомы. Химия изучает свойства различных атомов, пути, по которым они объединяются между собой, образуя молекулы, и взаимодействие молекул различных типов друг с другом.
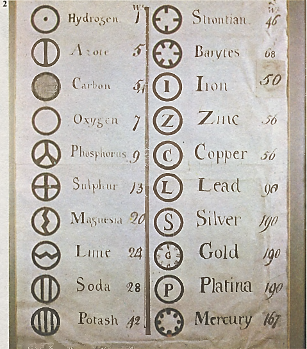
Древние греки (в частности, Демокрит) полагали, что вещество состоит из мельчайших частиц, которые они назвали атомами. Однако «атомизм» не находил признания до тех пор, пока Дальтон не предположил, что атомы различаются по массе и что масса каждого атома неизменна. В 1806 г. Дальтон опубликовал таблицу символов различных видов атомов (элементов).
О строении атомов. С точки зрения химика, атомы построены из трех видов еще более мелких субатомных частиц-протонов, нейтронов и электронов. Нейтрон не имеет электрического заряда, тогда как протон обладает единичным положительным зарядом. Точно такой же по величине, но отрицательный заряд несет электрон, только электрон намного легче протона.
Протоны и нейтроны в атоме объединены в ядро, расположенное в центре атома. Вокруг ядра находятся электроны. Атомный радиус незаряженного (электрически нейтрального) атома, т. е. среднее расстояние от совокупности электронов до ядра, примерно в 10000 раз больше, чем размеры ядра. Таким образом, пространство внутри атома в значительной мере оказывается пустым. Вследствие этого, когда два атома сближаются, взаимодействие их электронов будет намного более вероятным, чем непосредственный контакт между двумя ядрами.
Разные виды атомов образуются в результате объединения различного числа протонов, нейтронов и электронов. Число протонов в атоме равно его атомному номеру, а общая масса входящих в его состав субатомных частиц определяет атомную массу. Простейший из атомов-атом водорода-состоит из 1 протона и 1 электрона. Если к ним добавляется еще 1 нейтрон, то возникает разновидность водорода-дейтерий. Во многих случаях поведение атомов водорода (иногда его называют протием) и дейтерия одинаково, как и следовало ожидать от двух атомов, имеющих по одному-единственному электрону. Поэтому такие атомы химики рассматривают как два различных изотопа одного и того же элемента. Существует и третий изотоп элемента водорода-тритий, который содержит в ядре 1 протон и 1 нейтрона. Однако, если в ядро трития добавить 1 протон, то для сохранения баланса электрических зарядов придется ввести еще 1 электрон. Образованный таким образом атом по своему химическому поведению будет совершенно не похож на изотопы водорода. Это атом совсем другого элемента-гелия.

Джон Дальтон благодаря своим работам по созданию атомистической гипотезы считается одной из выдающихся фигур в истории химии. Он родился в Камберленде (Англия) в 1766 г. в семье ткача. В 12 лет стал школьным учителем. В 1793 г. Дальтон переехал в Манчестер, где и работал до конца жизни (1844). Кроме атомистической теории (ее создание было завершено в начале XIX в.), Дальтон, страдавший болезнью зрения (неразличением цветов), известен своими работами по цветовой слепоте (называемой иногда дальтонизмом) и метеорологии.
Что такое элементы. Под элементом понимают совокупность атомов, имеющих одинаковое число протонов в ядрах. Число нейтронов может при этом несколько различаться, что приводит к появлению ряда изотопов. Изотопы одного и того же элемента обладают различной массой, но их химические свойства одинаковы. В природе существует большое число устойчивых (стабильных) изотопов. Однако изотопы элементов, в ядрах которых содержится примерно 90 и более протонов (например, изотопы урана), неустойчивы: их атомы распадаются, превращаясь в атомы других элементов. На нестабильности ядер тяжелых элементов основано действие ядерных реакторов и атомных бомб.
Электроны атомов располагаются вокруг ядра согласно определенным закономерностям. Положительно заряженные протоны ядра притягивают отрицательно заряженные электроны, однако кинетическая энергия движения электронов вокруг ядра препятствует их «падению» на ядро.
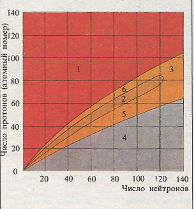
Ядро атома состоит из протонов и нейтронов. Устойчивостью обладают лишь ядра с определенной комбинацией этих частиц (2). Атомные ядра, содержащие в большом избытке протоны (1) или нейтроны (4), в высшей степени неустойчивы. Вне области устойчивых ядер имеется группа атомов (3), ядра которых распадаются с образованием легких более стабильных атомов. Ниже (5) и выше (6) расположена область нестабильных ядер, которые подвержены радиоактивному распаду.
Электронные орбитали. Электрон в атоме водорода «распределен» в пределах сферической оболочки, окружающей ядро. С определенной вероятностью в какой-то момент времени электрон можно обнаружить в той или иной точке этого пространства. Область вокруг ядра, где с наибольшей вероятностью можно обнаружить электрон, и представляет собой электронную орбиталь.
В 1925 г. швейцарский физик Вольфганг Паули сформулировал правила заполнения электронных оболочек. Основное правило гласит: в одном и том же атоме не может быть двух электронов, находящихся в одинаковых квантовых состояниях. Квантовые состояния электронов в атоме определяются набором из четырех квантовых чисел. Первое из них, главное квантовое число, описывает среднее удаление электрона от ядра. Второе квантовое число относится к форме орбитали, которая далеко не всегда бывает сферической. Третье из чисел определяет пространственную ориентацию орбитали.
Наконец, четвертое квантовое число характеризует спин электрона, который может быть равен только +1/2 или — 1/2. Возможные значения второго и третьего квантовых чисел зависят от значения главного квантового числа: если оно равно 1, то существует только два возможных квантовых состояния (и, следовательно, одна орбиталь, электроны на которой имеют разные значения спина), если же оно равно 2, то существует 8 квантовых состояний. При значении главного квантового числа, равном 3, имеется 18 квантовых состояний и т. д. в соответствии с формулой 2n2, где n- главное квантовое число.
Энергия электрона зависит от величин первых двух квантовых чисел, а поскольку поведение электрона в основном определяется его энергией, химики разработали символический сокращенный способ описания энергетических состояний электронов с помощью цифры и следующей за ней буквы. Цифра совпадает с главным квантовым числом, а величины 0, 1, 2 и 3 для второго квантового числа по традиции обозначаются латинскими буквами s, р, d и f. Зная количество электронов на различных орбиталях, можно предсказать свойства любого отдельного атома.
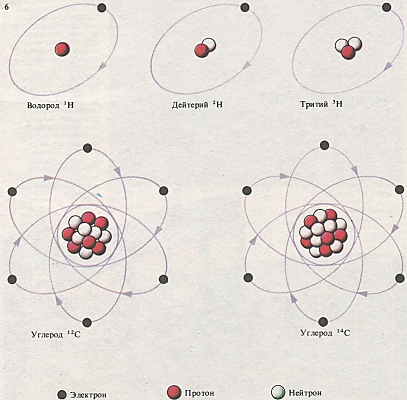
Ядра изотопов одного и того же элемента имеют одинаковое число протонов, но различаются по числу нейтронов. Атом водорода имеет 1 протон. Ядро обычного водорода не содержит нейтронов, в ядро дейтерия входит 1 нейтрон, а радиоактивный тритий имеет в ядре 2 нейтрона. Устойчивый изотоп углерода, углерод-12 (12С), имеет 6 протонов и 6 нейтронов, а углерод-14 (14С) с 8 нейтронами радиоактивен

Радиоактивный распад нестабильных изотопов удается использовать. Радиоактивные изотопы (радиоизотопы) широко применяются в медицине. Например, Йод усваивается щитовидной железой, причем радиоактивный Йод может быть обнаружен специальными приборами. Это позволяет оценить размеры и точное положение щитовидной железы, увидеть, не поражена ли она болезнью, опухолью или не увеличена ли она.
Дата добавления: 2022-01-31; просмотров: 858;
