Группы химических элементов
Электроны в атоме распределяются по электронным оболочкам строго определенным образом. Свойства конкретного элемента зависят главным образом от количества электронов на внешней электронной оболочке. Детальное строение внешней электронной оболочки описывается периодическим законом, который позволяет строго объединить отдельные элементы в группы или семейства.
s-Элементы и их свойства. Каждая электронная оболочка охватывает определенный объем пространства и включает s-, p-, d- и f-орбитали (в этом же порядке возрастает энергия орбиталей в пределах одной оболочки). Элементы, у которых на внешней электронной оболочке имеется один или два электрона, образуют так называемое семейство s-элементов (поскольку в этом случае электронами заселена только s- орбиталь). Помимо водорода и гелия к семейству s-элементов относятся литий, бериллий и все элементы, расположенный в периодической системе непосредственно под этими двумя металлами. Названные элементы (кроме гелия) легко теряют электроны внешней электронной оболочки, образуя положительно заряженные ионы, которые являются составной частью ионных соединений, обычно называемых солями. Эти элементы входят в состав многих распространенных веществ, например, натрий (Na) содержится в соде, калий (К)-в поташе, кальций (Са)-в гипсе, магний (Mg)-в карналлите.
s-Элементы, имеющие на внешней оболочке только один электрон, более активны в химических реакциях, чем элементы, имеющие два электрона. Если в воду бросить кусочек металлического натрия, то реакция происходит настолько бурно, что и натрий, и выделяющийся водород воспламеняются. Порошок магния также реагирует с водой достаточно легко, хотя и не настолько бурно; реакция (выделение водорода) начинается только в горячей воде.
У более тяжелых элементов энергия электронов на внешних оболочках изменяется несколько более сложным образом. У многих элементов s-орбитали заполнены полностью, а d-орбитали — лишь частично. Часть таблицы Менделеева, начиная со скандия (Sc), включает 10 переходных элементов, у которых происходит постепенное заполнение d- орбиталей; их химические свойства определяются также наличием d-электронов. Лантаноиды образуют дополнительные подгруппы: у них начинается заполнение f-орбиталей, над которыми расположены d-орбитали с одним электроном из десяти возможных и полностью завершенная s-орбиталь внешней оболочки.
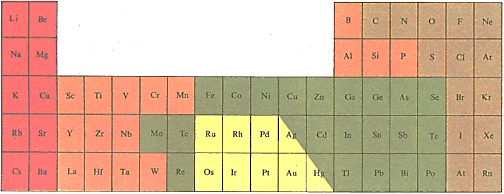
Элементы выделяют из минералов различными способами. Красным отмечены наиболее активные металлы. Обычно их получают с помощью электролиза. Оранжевым отмечены элементы, которые часто образуют ионные соединения, например с кислородом; их выделяют электролизом. Элементы, отмеченные зеленым, встречаются в природе чаще всего в виде сульфидов. В свободном состоянии их получают после обжига сульфидов восстановлением образующихся при этом оксидов. Относительно мало реакционноспособные вещества (отмечены желтым) встречаются в природе в самородном состоянии или же выделяются при нагревании их природных соединений. Светлокоричневым цветом отмечены неметаллы. Они встречаются в природе в свободном состоянии или входят в состав соединений; тогда их выделяют с помощью электролиза.

Магний относится к числу активных s-элементов. На воздухе он горит ярким белым пламенем и раньше широко использовался в фотографии в качестве «вспышки». Подожженный на воздухе магний продолжает гореть даже под водой.
Вольфрам был впервые получен в чистом виде в 1783 г. братьями д’Элуяр. Вольфрамовые нити используются в лампах накаливания
d-Элементы, «редкие земли» и металлы. Химические свойства скандия (Sc), иттрия (Y), лантана (La) и всех лантаноидов (14 элементов), определяются наличием единственного d-электрона. Эти элементы легко теряют d-электрон и два s-электрона внешней оболочки, обычно образуя положительные ионы с зарядом + 3. Эти элементы достаточно реакционноспособны. Они мало распространены в природе, почему и получили название «редкоземельные»; однако некоторые из них находят применение в промышленности, например в производстве разноцветных стекол для светофоров.
Большое значение имеет подгруппа актиноидов, поскольку в нее входят уран и плутоний, используемые в ядерных реакторах. Но важность этих элементов скорее определяется неустойчивостью ядер, чем особенностями их химических свойств.
Велика роль и других переходных элементов, относящихся к металлам. Многие из них получили самое разнообразное применение в технике. Все эти элементы (исключая медь, серебро и золото) имеют по 2 электрона на внешней 5-орбитали и от 2 до 10 электронов на более прочно связанных d-орбиталях. Казалось бы, следовало ожидать, что медь, серебро и золото должны иметь два s-электрона и девять d-электронов, однако энергетически более выгодным оказывается полное заполнение d-орбиталей.
Переходные элементы характеризуются способностью образовывать положительные ионы или входить в состав отрицательных ионов. Это связано с более сложным поведением электронов на d- орбиталях. Так, для железа существуют ионы Fe2+ (потеряно 2 электрона) и ионы Fe3+ (потеряно 3 электрона).

Драгоценные металлы часто встречаются в природе в виде самородков. Это относится не только к золоту, которое на протяжении многих веков использовалось в ювелирном деле. На рисунке изображено золотое яйцо, изготовленное Фаберже. К драгоценным принадлежат также платиновые металлы. Серебро и ртуть находятся в пограничной области.
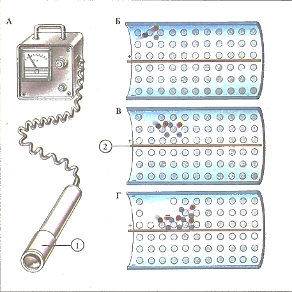
Счетчик Гейгера (А) используют для обнаружения радиоактивного излучения. Камера (1) заполнена при низком давлении неоном (Б). Атомы неона (серые) в камере ионизируются при попадании в них радиоактивных частиц (черные), образуя (В) положительные ионы (красные) и электроны (голубые). Электрическое поле (2) ускоряет заряженные частицы; они сталкиваются с другими атомами неона (Г), вызывая появление новых заряженных частиц

Мария Склодовская-Кюри первой из ученых была дважды удостоена Нобелевской премии. Одну из них она получила за работы по физике, вторую - по химии.
р-Элементы и их классификация. Справа от переходных элементов в периодической системе расположены р- элементы. Во главе групп стоят бор, углерод, азот, кислород, фтор и неон. Их химические свойства определяются прежде всего наличием трех р-орбиталей, которые могут иметь максимум 6 электронов. Слева направо по ходу этих групп происходит заполнение р-орбиталей внешней электронной оболочки электронами до тех пор, пока не достигается «полный октет» (два s- и шесть р- электронов) благородных газов. Это происходит в атоме неона. Благородные газы не склонны к химическим реакциям, и лишь в 60-х годах удалось получить соединения некоторых из них.
Группа, начинающаяся с фтора,-галогены. До завершения октета им недостает лишь 1 электрона, приобретая который они превращаются в отрицательные ионы с единичным зарядом. Элементы группы кислорода могут образовывать ионы с зарядом — 2, но при переходе от одной группы к другой влево более типичным оказывается не образование ионов, а возникновение неионных (ковалентных) связей. Эта тенденция еще более заметна в группах, начинающихся с азота и углерода. В группе, начинающейся с бора, атомы которого имеют два s- и один р-электрон, как и в группе, во главе которой стоит скандий, вновь появляется склонность к образованию ионов. Так, например, атомы алюминия легко теряют свои 3 электрона внешней оболочки, превращаясь в ионы Аl 3+ , однако хлорид алюминия (АlСl3) нельзя строго отнести к ионным соединениям. Связи между атомами хлора и алюминия носят частично ионный, а частично ковалентный характер.
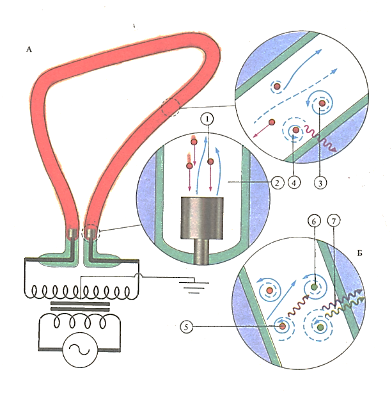
Неон-малоактивный элемент. Его используют в газоразрядных трубках (А). Положительные ионы неона (1), попадая на отрицательно заряженный электрод, вызывают эмиссию новых электронов (2), которые, сталкиваясь с атомами неона, переводят их в «возбужденное» состояние (3). Возвращаясь в «основное» состояние (4), атомы излучают энергию в виде красного света. В ртутных лампах (Б) испускается ультрафиолетовое излучение (5), которое поглощается слоем флуоресцирующего вещества (6), вызывавшего длительное свечение (7).
Дата добавления: 2022-01-31; просмотров: 726;
