Атомная масса. Атомные номера
С той поры, когда человек впервые начал получать металлы из горных пород, прошло несколько тысячелетий. За это время люди многое узнали о том, как ведут себя различные вещества, и попытались обнаружить черты сходства и различия в их поведении. Но глубокое проникновение в общие закономерности химической природы элементов было невозможным, пока около 100 лет назад русский химик Д. И. Менделеев (1834-1907) не создал периодическую систему элементов.
Еще раньше французский химик Антуан Лавуазье (1743-1794) возродил употребление термина «элемент», предложенного Робертом Бойлем, для обозначения таких веществ, которые уже не могут быть превращены в какие-либо более простые вещества.

Русский химик Д. И. Менделеев - создатель периодической системы элементов (1869). Открытие периодического закона было важнейшим теоретическим достижением, которое позволило построить систему классификации элементов и объяснить причины ранее непонятного сходства свойств некоторых элементов. Д. И. Менделеев родился в 1834 г. в Тобольске, работал преподавателем в Петербурге. Впоследствии стал профессором Петербургского университета, где работал до 1890 г. Умер в 1907 г.
Атомная масса. По мере открытия новых элементов и более широкой систематизации их свойств становилось ясным, что некоторые элементы сходны в своем поведении. Так, натрий и калий, впервые полученные в начале XIX в. Гемфри Дэви (1778-1829), оба представляют собой довольно мягкие и пластичные металлы, которые бурно реагируют с водой, образуя щелочные растворы. Постепенно становилось очевидным, что можно составить такую таблицу элементов, где будет отражено сходство отдельных групп элементов между собой.
Одним из свойств элементов, которое тогда позволяло произвести их систематизацию, была атомная масса. Атом чрезвычайно мал-детский мячик мог бы легко вместить в себя квадрильон атомов (это число выражается единицей с 24 нулями). Тем не менее каждый атом имеет определенную массу. Основной вклад в массу атома вносят протоны и нейтроны, составляющие его ядро. Например, атом дейтерия, имеющий в ядре 1 протон и 1 нейтрон, почти вдвое тяжелее атома водорода (протия), имеющего 1 протон. Атом кислорода, в ядро которого входят 8 протонов и 8 нейтронов, примерно в 16 раз тяжелее атома водорода.
Используя разнообразные тонкие методы анализа, химики прошлого века постепенно составляли таблицы относительных атомных масс, причем точность их постоянно возрастала. Сначала за единицу атомной массы была принята масса атома водорода, и массы других атомов сравнивали с ней. В наши дни в качестве стандарта принята одна двенадцатая массы атома углерода 12С, имеющего 6 протонов и 6 нейтронов. При этом масса атома водорода равна 1,008 углеродной единицы.
Располагая элементы в порядке возрастания атомных масс, Менделеев построил периодическую систему элементов. В отличие от таблиц, предлагавшихся другими химиками, его таблица имела ряд пропусков. В тех случаях, когда различие в значениях атомных масс двух соседних известных элементов казалось непропорционально большим, Менделеев предполагал, что между ними должен находиться элемент с промежуточным значением атомной массы. Поскольку элементы в таблице Менделеева были объединены в семейства со сходными свойствами, он смог предсказать свойства некоторых еще не известных элементов. Незадолго до конца XIX в. его предсказания подтвердились открытием ряда «недостающих» элементов, причем их действительные свойства оказались в хорошем согласии с предсказанными Менделеевым.

Атомные номер. Ныне установлено, что физический смысл периодического закона заключен не в атомных массах, а в атомных номерах, т. е. в основе построения периодической системы лежит число протонов в ядрах атомов элементов. Периодичность в изменении свойств элементов является результатом сходства строения их электронных оболочек.
В атоме лития (Li) имеется 3 электрона, а в атоме калия (К)-19. В соответствии с правилами заполнения электронных орбиталей литий имеет столько электронов, что они полностью заполняют орбиталь с главным квантовым числом 1. Один оставшийся электрон оказывается на следующей, более высокой по энергии 2s-орбитали. У калия электронами полностью заполнены все возможные орбитали первых трех электронных оболочек, и остается еще один электрон. Он занимает 4s-орбиталь. Следовательно, оба элемента имеют на самой удаленной от ядра орбитали по одному-единственному электрону.
Если два атома имеют на самой удаленной от ядра (внешней) электронной оболочке одно и то же число электронов, то разумно ожидать, что их химические свойства должны быть сходными.
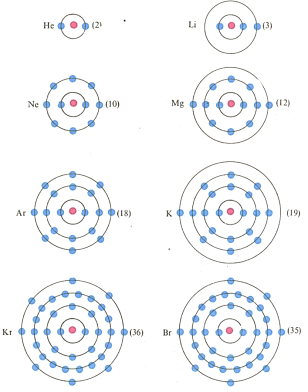
Периодичность свойств элементов обусловлена их электронным строением. Электроны в атоме распределены по электронным оболочкам, каждая из которых может быть заполнена строго определенным числом электронов. Первые три оболочки могут содержать соответственно 2, 8 и 18 электронов. Если внешняя оболочка заполнена полностью или содержит 8 электронов, то такой элемент не склонен вступать в соединение с другими элементами. Этому условию удовлетворяют благородные газы: гелий (Не), неон (Ne), аргон (Аг), криптон (Кг), ксенон tXe), радон (Rn).
Искусственные элементы. На протяжении многих лет считали, что элемент с номером 92 (уран) обладает наиболее массивными из всех, встречающихся на Земле, атомами. Предполагалось, что с увеличением размеров атомов элементы становятся менее устойчивыми и атомы более тяжелых элементов, если они и существовали когда-либо на Земле, подверглись распаду. Однако начиная с 1940 г. химики США и СССР начали получать «трансурановые элементы» искусственно. Глен Си- борг (род. 1912), используя периодический закон, предсказал возможные свойства трансурановых элементов вплоть до элемента с номером 168. К сожалению, лишь немногие из этих элементов достаточно устойчивы, чтобы можно было выяснить, насколько согласуются их реальные свойства с предсказанными Сиборгом.
Другая гипотеза Сиборга подтвердилась. Поскольку элементы, входящие в одну и ту же группу периодической системы, обладают сходными свойствами, они часто встречаются вместе в одних и тех же природных минералах. Си- борг предположил, что если какие-либо следы трансурановых элементов еще остались на Земле, то их можно будет найти в минералах, богатых другими элементами той же группы. И действительно, в 1971 г. в образце урановой руды был обнаружен природный плутоний.

Дата добавления: 2022-01-31; просмотров: 790;
