Строение молекул. Форма ковалентных молекул
Интерес людей к химии развивался по мере накопления тех полезных сведений о свойствах различных веществ, которые она давала. Зная, как построены молекулы и как они взаимодействуют между собой, можно было создать новые полезные вещества, например лекарства, строительные материалы или синтетические ткани. Химия позволила понять, какие изменения происходили на Земле прежде и как она будет развиваться в дальнейшем. Этим занимается одна из ветвей химии-геохимия, которая помогает в поисках горючих ископаемых, металлических руд, а также способствует улучшению способов их переработки.
Строение молекул. Большинство веществ построено из молекул, а те в свою очередь-из атомов. Одним из основных направлений химии является изучение строения молекул. Атом сам по себе довольно прост: маленькое «жесткое» ядро окружено электронными «облаками», распределенными в пространстве по законам вероятности. Молекулы, состоящие из атомов, построены аналогично, но объем, занимаемый здесь электронными орбиталями, несколько больше. Тем не менее, хотя на каждой орбитали не может быть
больше 2 электронов, орбитали обычно строго ориентированы в пространстве. В результате каждая молекула имеет определенную форму. Для сложных молекул форма имеет решающее значение, определяя специфические свойства вещества. Это особенно существенно для молекул органического вещества, состоящих иногда из тысяч атомов, соединенных в единое целое. Однако даже при относительно несложных молекулах свойства вещества зависят от их пространственного строения.
Структура ионных соединений обусловлена величиной электрического заряда и размерами ионов. К примеру, ион натрия можно рассматривать как маленький шарик определенного диаметра. Как правило, если ионы различных элементов обладают одинаковыми зарядами и близкими радиусами, то они могут заменять друг друга в различных веществах. В те далекие времена, когда формировалась наша планета, происходила кристаллизация горных пород из расплавленной магмы. Многие из древнейших пород содержат твердые кристаллические вещества, однако эти вещества почти всегда не однородны по составу. Так, обычный минерал-калийный полевой шпат представляет собой ионное соединение, состоящее из калия, кремния и кислорода, однако оно содержит и рубидий, так как последний образует ионы того же заряда и почти такого же размера, что и калий. Размеры и заряд частиц, образованных германием и кремнием, также близки друг к другу, поэтому полевой шпат обычно «загрязнен» и германием.
В ковалентных соединениях связи между различными атомами отличаются друг от друга. Ковалентные вещества тоже могут образовывать кристаллы, однако в узлах кристаллической решетки в этом случае располагаются уже целые молекулы, а не отдельные ионы, как в веществах с ионной связью. В кристаллах ковалентных веществ каждая молекула сохраняет свою форму.
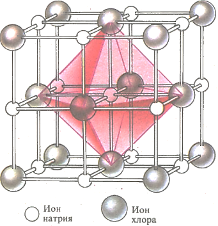
Хлорид натрия, обычная поваренная соль, имеет кубическую кристаллическую структуру. В узле кристаллической решетки каждый ион натрия (Na + ) окружен 6 ионами хлора (С1-) , а каждый ион хлора точно так же окружен 6 ионами натрия. Ионы удерживаются в узлах решетки силами электростатического притяжения и отталкивания.

Форма кристалла вещества ионного характера зависит от размеров и числа образующих его ионов. Однако различные вещества могут выглядеть почти одинаковыми, хотя обладают различными молекулярным строением и химическими свойствами. Дисульфид железа (пирит), изображенный на рисунке, называют иногда золотой обманкой – из за его внешнего сходства с золотом.

Молекула перекиси водорода состоит из 2 атомов водорода и 2 атомов кислорода. Она легко разлагается, отщепляя кислород. Перекись водорода обесцвечивает волосы, а также используется как мягкое дезинфицирующее средство.
Форма ковалентных молекул Форма молекул с ковалентными связями зависит от формы электронных орбиталей, причем не только тех, которые непосредственно участвуют в образовании связей, но и тех, которые вообще имеются у каждого атома. Так, молекула воды, где каждый из двух атомов водорода соединен с центральным атомом кислорода, имеет треугольную форму. Поскольку электроны в молекуле несут отрицательный заряд и отталкиваются друг от друга, это, казалось бы, должно было привести к линейной форме молекулы. В таком случае отталкивание между электронами водорода и кислорода было бы минимальным. Однако у атома кислорода помимо 2 электронов, участвующих в образовании химических связей, на заполненных орбиталях имеется еще две пары электронов-«свободные электронные пары». Их влиянием на соседние пары электронов нельзя пренебречь. Если его учесть, то получится фрагмент структуры, напоминающий структуру алмаза: тетраэдрическое расположение как двух пар электронов связи кислорода с водородом, так и двух пар свободных электронов. В этом случае все пары электронов удалены друг от друга настолько, насколько это возможно.
В метане атом углерода окружен 4 атомами водорода, и все 4 электрона внешнего слоя атома углерода участвуют в образовании связей. Метан представляет собой правильный тетраэдр. Структурой, промежуточной между структурами воды и метана, обладает аммиак (NH3), в котором имеются три ковалентные связи азота с водородом и одна заполненная орбиталь (свободная пара электронов) у атома азота.
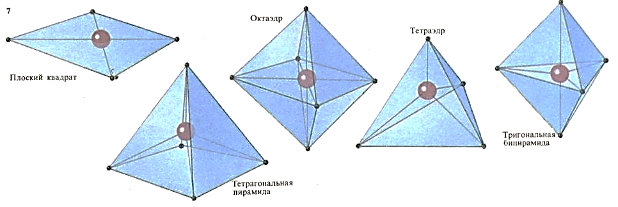
Если в молекуле с центральным атомом связано несколько других атомов или групп атомов, то они могут быть расположены вокруг него различным образом. Частным случаем могут служить координационные соединения. Молекулы этих соединений обычно имеют одну из изображенных здесь геометрических форм. Если, допустим, центральным является атом кобальта, то 4 связанные с ним группы могут находиться либо в углах квадрата, либо в вершинах тетраэдра. Как они будут расположены зависит от влияния электронов, не участвующих в образовании связей, но имеющихся в группах, связанных с центральным атомом.
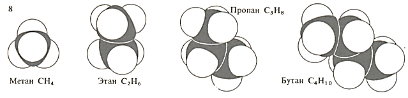
Атомы углерода могут соединяться друг с другом, образуя длинные цепи. Углерод образует ряды соединений со сходными строением и свойствами, например парафины (алканы). Модели молекул первых четырех членов этого ряда изображены на рисунке.
Координационные соединения. Свободные пары электронов воды и аммиака могут в свою очередь образовывать связи с ионами металлов, имеющими незаполненные орбитали. Например, безводный сульфат меди представляет собой порошок белого цвета. Под действием воды он приобретает синюю окраску, так как несколько молекул воды «координируются» своими свободными парами электронов на незанятые орбитали иона меди. Поскольку незанятые орбитали ионов металлов имеют определенную направленность, большинство координационных соединений обладает определенной, как правило, более сложной геометрической структурой.
Некоторые атомы могут образовывать несколько связей с другими атомами; встречаются молекулы одного и того же состава, но с разным порядком соединения атомов между собой. Одним из наиболее важных достижений химии 40-х годов нашего столетия было создание тонких методов исследования, позволяющих точно устанавливать пространственную структуру веществ.
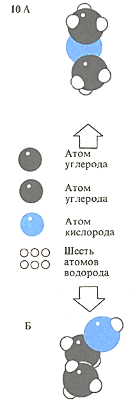
Одно и то же число одинаковых атомов может соединяться с другим атомом различным образом, что ведет к отличию в свойствах образующихся веществ. Такие вещества называют структурными изомерами. Примерами изомеров служат диметиловый эфир (А) и этиловый спирт (Б).
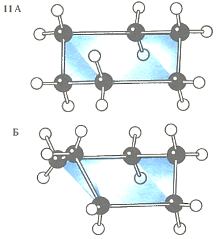
Некоторые соединения могут существовать в двух различных формах, различающихся только пространственным расположением связей между атомами. На рисунке изображены модели молекул циклогексана в формах «кресла» (А) и «ванны» (Б). Такие формы молекул, которые могут превращаться друг в друга без разрыва связей, получили название «конформации».
Дата добавления: 2022-01-31; просмотров: 679;
