Пути метаболизма аминокислот
При изучении данного и последующих разделов книги, для облегчения восприятия биохимических аспектов темы, рекомендуется не только пользоваться иллюстрациями в тексте, но и обращаться к известной схеме «Метаболические пути» Д. Николсона.
В норме концентрация свободных аминокислот в плазме крови невысока — 4-8 мг/дл. Почти половина аминоазота крови приходится на аланин. Приём аминокислот в пищу и их внутривенное введение, при здоровой печени, на удивление мало влияют на этот показатель.
В течение 5 минут почти 100% дозы оказывается в тканях. Главный поглотитель аминокислот — печень, менее активны почки. Классические данные М. Фишлера показали, что для захвата печенью всосанных в кишечнике аминокислот не является принципиально важным, как именно они попадут в печень — по v. porta или по a. hepatica. После наложения экковской фистулы аминоазот плазмы растёт незначительно и ненадолго. Мозг поглощает аминокислоты быстро, но избирательно, предпочитая гистидин, глицин, аргинин, метионин, глутамин, глутаминовую кислоту и тирозин. В эритроцитах аминокислот в 2 раза больше, чем в плазме. Гипераминоацидемия является показателем сниженной утилизации аминокислот, прежде всего, печёночной.
Печень, как главный орган белкового метаболизма, выполняет ряд важных функций (рис. 11).
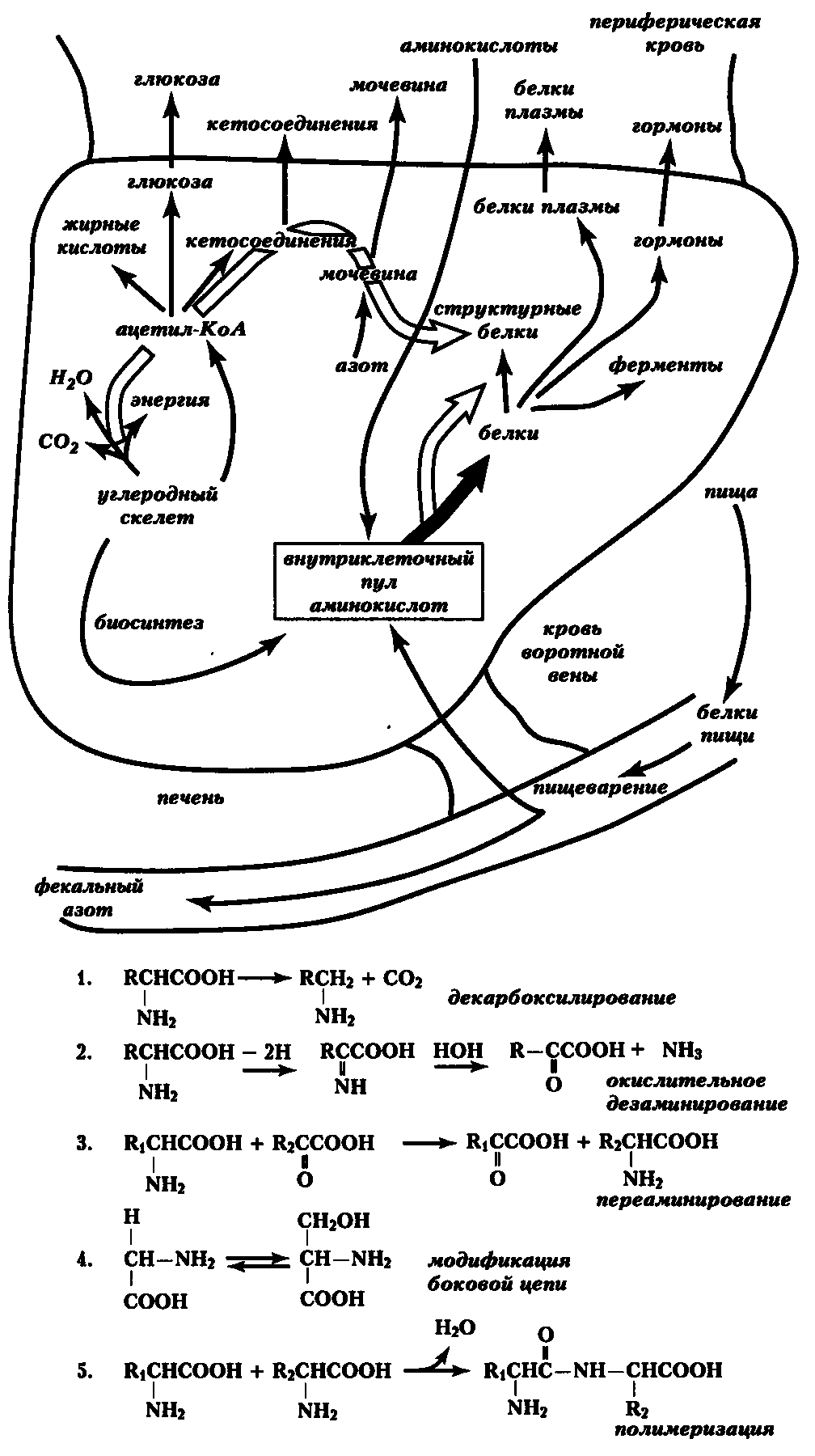
Рис. 11. Основные реакции с участием аминокислот (По Я. Мусилу и соавт., 1981). Пояснения в тексте
Среди них:
- Переаминирование аминокислот, то есть обратимый перенос их аминогруппы на а-кетокислоты без освобождения аммиака. Этот процесс, открытый отечественными биохимиками А.Е. Браунштейном и М.Г. Крицман (1937), обеспечивает образование структурно новых заменимых аминокислот. В нём непосредственно могут принимать участие все аминокислоты, кроме треонина, а также их амиды.
Центральную роль играет кофермент трансаминаз — витамин В6 и, во многих случаях, посредником служит глутаминовая кислота, которая, наряду со своим кетоаналогом, а-кетоглутаровой кислотой, используется для переноса аминогруппы между различными кетоскеле- тами. Благодаря переаминированию печень обеспечивает перераспределение аминного азота и доводит пищевую смесь до балансового оптимума, так как этот процесс даёт возможность понизить до требуемого уровня концентрации любых аминокислот, кроме треонина, и повысить содержание любых заменимых аминокислот, если их не хватает. Оптимальная смесь, благодаря этому, переносится кровью во все органы.
Переаминирование — ключевое звено взаимосвязи белкового метаболизма с жировым и углеводным. Кетокислоты могут возникать из небелковых предшественников. Аминокислоты через переаминирование могут терять аминный азот и превращаться в кетокислоты, после чего их углеродные фрагменты могут входить в состав глюкозы и гликогена, а перед этим обнаруживаться в пирувате, оксалате или а-кетоглутарате (гликогенные аминокислоты — например, аланин, валин и еще 14 наименований). Фрагменты других аминокислот появляются в ацетоацетате и ацетилкоэнзиме А (кетогенная аминокислота лейцин) или же как в гликогенных, так и в кетогенных предшественниках (изолейцин, фенилаланин, тирозин, лизин). После переами- нирования создаётся возможность использовать продукты дезаминирования в глюконеогенезе и для образования кетоновых тел и липидов включая стероиды.
- С переаминированием тесно связан процесс окислительного дезаминирования, осуществляемый аминооксидазами печени. При этом аминокислоты расщепляются до аммиака, воды и кетокислота. Как правило, сначала идёт В6-зависимое переаминирование аминокислоты с образованием глутаминовой кислоты, которая и подвергается затем окислительному дезаминированию. Равновесно сопряженный с данным процессом путь восстановительного аминирования ведет к нейтрализации аммиака и превращению кетокислоты в аминокислоту с присоединением водорода, донором которого выступают витамин В2-зависимые флавиновые ферменты.
Для аминирования необходима доступность кислот цикла Кребса. Глутамат, образуемый при переаминировании, в печёночных митохондриях может либо окисляться через дезаминирование, либо переаминируется с оксалоацетатом, давая аспарагиновую кислоту — донора аминного азота для производства мочевины (см. ниже раздел «Нарушения конечных этапов метаболизма белка»).
Направление равновесных процессов переаминирования и аминирования-дезами- нирования во многом зависит от наличия и концентраций аминокислот и а-кетокислот. При избытке аминного азота усиливается превращение аминокислот в кетоаналоги, с их последующей энергетической или пластической утилизацией.
Во многих метаболических ситуациях дикарбоновые кетокислоты становятся малодоступны. Это бывает при нарушениях цикла Кребса, гиповитаминозе Вь тканевой гипоксии, инсулиновой недостаточности, а также, в особенности, при отравлении аммиаком и печёночной недостаточности, когда замедляется образование мочевины, и аммиак в тканях связывает дикарбоновые кетокислоты. Подобные измененимогут увеличить содержание свободных аминокислот в крови, затормозить переаминирование, направить ацетилкоэнзим А, не утилизируемый циклом Кребса, на синтез кетоновых тел, способствовать развитию ацидоза (Н.Н.Лаптева, 1970). С другой стороны, усиленное переаминирование в клетках мозга при печёночной недостаточности тормозит осуществление самого цикла Кребса и вызывает тканевую гипоксию нейронов, дефицит АТФ, нарушение работы ионных насосов и, как следствие, деполяризацию и невозбудимость нервных клеток, что проявляется картиной печёночной комы.
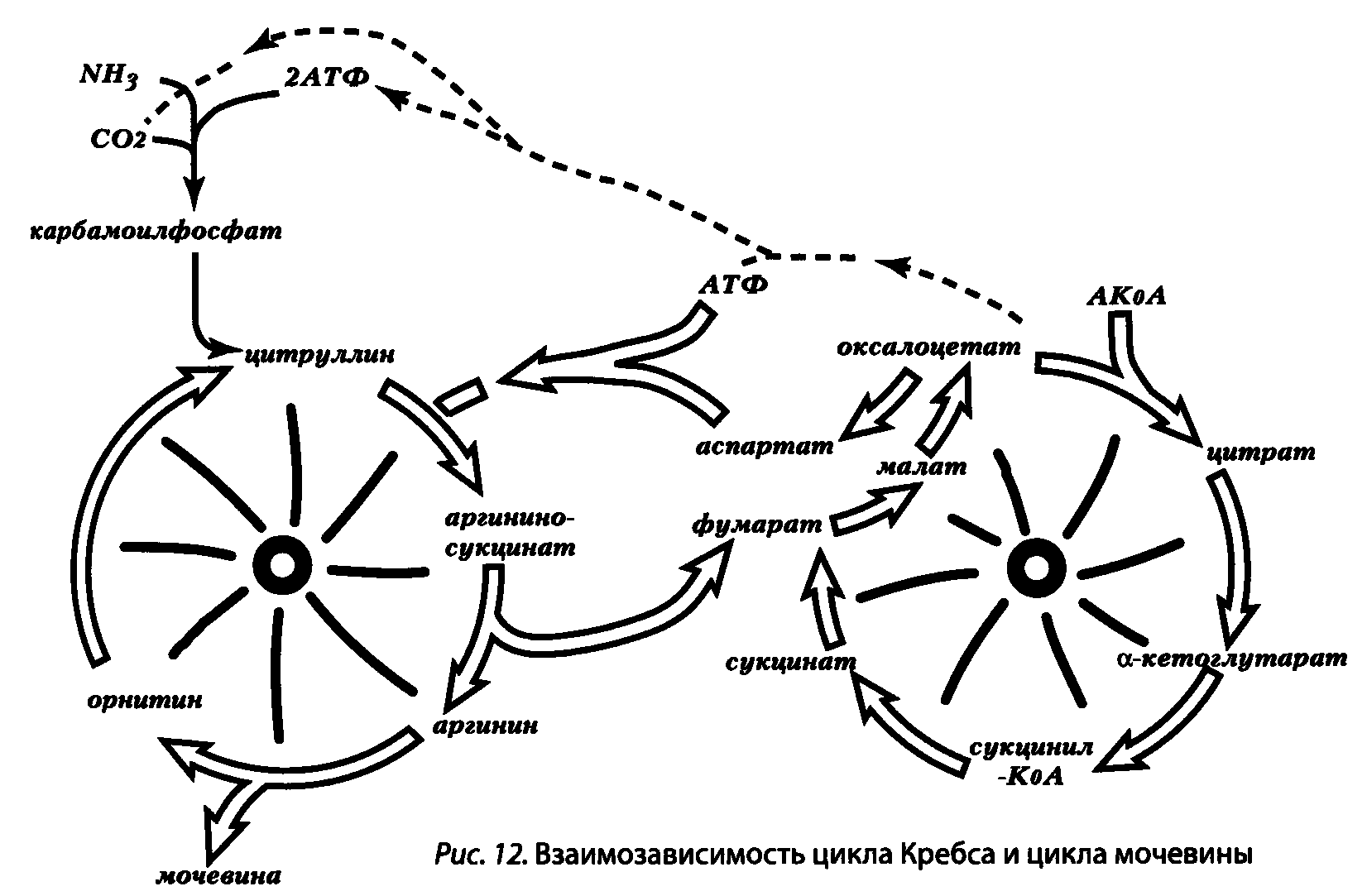
Кома как синдром глубокого угнетения ЦНС вследствие тканевой гипоксии потому и универсальна по своей симптоматике, несмотря на разные причины, что из-за взаимосвязи цикла Кребса, переаминирования и цикла мочевины, для клеток, в частности нервных, любая глубокая тканевая гипоксия оборачивается нарушением переаминирования и первичной нейтрализации аммиака, а нарушение нейтрализации аммиака печенью, наоборот, истощает пул дикарбоновых кислот и вторично затрагивает цикл Кребса в ЦНС (подробнее см. ниже раздел «Нарушения конечных этапов метаболизма белка»). Эти взаимоотношения подробно будут рассмотрены при изложении основ патологии печени в т. III данного руководства. Но уже здесь авторам кажется уместным привести рис. 12, отражающий взаимодействие двух циклов — мочевины и Кребса — как двух колёс одного велосипеда, из которых ни одно не способно «вращаться» без исправного вращения второго!
- Печень направляет аминокислоты на синтез собственных белков, белков плазмы крови и в другие органы (см. рис. 11, вверху). Новые белки не встраивают пептиды старых, а синтезируются всегда заново. Очень быстрый ресинтез белка из аминокислот постоянно происходит в нервной и мышечной ткани, в железах внутренней секреции, поставляющих пептидные и аминокислотные гормоны, а также во всех быстропролиферирующих клетках. Экспортируемые клеткой белки обмениваются быстрее собственных. В то же время, скорость обновления аминокислот в ряде белков опорно-двигательного аппарата, например, коллагене — минимальна.
- Печень синтезирует с участием аминокислот небелковые расходуемые азотсодержащие соединения — пурины, пиримидины, мочевую кислоту, креатин и никотиновую кислоту (последнюю у человека — в недостаточных количествах). Продукты метаболизма этих соединений или их избыток выводятся почками, как и мочевина.
В печени, мозге, хромаффинной ткани надпочечников, параганглиях, диффузных нейроэндокриноцитах и многих других тканях происходит декарбоксилирование некоторых аминокислот (гистидин, тирозин, триптофан, глутаминовая кислота и др.) с образованием аминов (гистамина, тирамина, окситирамина, триптамина, серотонина, у-аминомасляной кислоты и т.д.).
В свою очередь, амины окисляются моноаминоксидазами тканей. Из-за нейротран- смиттерной и гормональной роли этих соединений, а также освобождения активных кислородных радикалов при их метаболизме данный путь обмена аминокислот имеет большое значение для регуляции гомеостаза (см. также разделы «Нарушения переваривания белков...», «Патофизиология эндокринной регуляции»).
Дата добавления: 2022-01-31; просмотров: 681;
