Периоды голодания и их эндокринно метаболическая характеристика
Полное голодание делят по особенностям обмена веществ и энергии на несколько периодов. Это перекликается с клинической классификацией на три степени тяжести (соответствующие идущим друг за другом периодам).
В классический период развития учения о голодании патофизиологи основывали свои заключения на наиболее общих макропоказателях хода обменных процессов. П.П. Авроров по удельной теплопродукции выделял начальный период голодания, характеризующийся ограничением окислений и повышением дыхательного коэффициента (ДК), наиболее длительный период стабилизации удельной теплопродукции на субнормальных уровнях при сниженном ДК и непродолжительный терминальный период активизации окислений с повышением ДК. При этом, кривая выведения мочевого азота была, до известной степени, параллельна колебаниям удельной теплопродукции.
Полного параллелизма, однако, не наблюдалось. Известно, что у здорового человека 1-1,3 мг азота мочи приходится на каждые 1000 калорий основного обмена. Однако, при голодании происходит перенирование аминокислот скелетных мышц, позволяющее сберечь белок висцерального пула. Резкое повышение выведения азота запаздывает по отношению к кратковременному начальному приросту Д К и относится не к 1-му, а к 3-5 дням полного голодания. Начиная со 2-й и примерно до 8-й недели голодания, у человека выведение азота значительно снижается и стабилизируется. Затем следует терминальный скачок выведения азота, о котором шла речь выше.
Клиницисты еще в XVIII веке выявили сухую и отёчную формы голодания (см. ниже «Квашиоркор и алиментарный маразм»), но, несмотря на явные отличия их симптомов, отметили их единое стадийное течение. В настоящее время ясно, что компенсация при голодании обеспечивается использованием жира и аминокислот соматического пула (жировой ткани, скелетных мышц), а декомпенсации соответствует начало интенсивного использования белков висцеральных органов на энергетические нужды. Сухая форма голодания характеризуется относительно длительным компенсированным периодом, а отёчная — более коротким.
С учётом этих данных, может по-прежнему быть полезна старая клиническая классификация голодания по Л.И. Виленскому (1943), Г.Ф. Лангу (1943), А.Л. Мясникову (1945), которая подразумевает:
- лёгкую или амбулаторную стадию, соответствующую эндогенному питанию за счёт углеводов и, главным образом, жиров. При данной стадии имеется общая слабость, угнетение психики, понижение физических и умственных способностей, сухость и бледность кожи, дефицит массы до 20 %, могут быть эпизодические преходящие отёки, но нет выраженных симптомов гиповитаминозов. Сохраняется чувство голода и нормальное пищевое поведение, при откармливании пища усваивается.
- среднетяжёлую или стационарную стадию, когда больной начинает использовать белки крови и мышц. Дефицит веса 20-40%, при протекании белково-энергетической недостаточности по квашиоркорному типу (см. ниже) характерны выраженные отёки. Могут быть адинамия, эпизодически — поносы, присутствуют симптомы полигиповитаминоза, пищевое поведение может быть изменено до апатии, чувство голода притуплено. При откармливании усвояемость пищи понижена и требуются специальные режимы питания.
- тяжёлую, необратимую стадию — с дефицитом массы более 40%, угрожающими жизни авитаминозами, вторичными инфекциями, анасаркой, диареей, далеко зашедшими дегенеративно-дистрофическими изменениями внутренних органов, полной неусвояемостью пищи при попытках откармливания.
Данные современной патохимии позволяют раскрыть механизмы эндокринно-метаболической адаптации, лежащие в основе периодизации голодания.
Процессы, которые происходят в организме взрослого человека, если его внезапно лишить пищи, характеризуются этапностью.
При голодании можно выделить период экстренной адаптации, период долговременной стабильной адаптации и период декомпенсации, каждый из которых имеет свои особенные черты.
Рассмотрим вначале период экстренной адаптации (рис. 6).
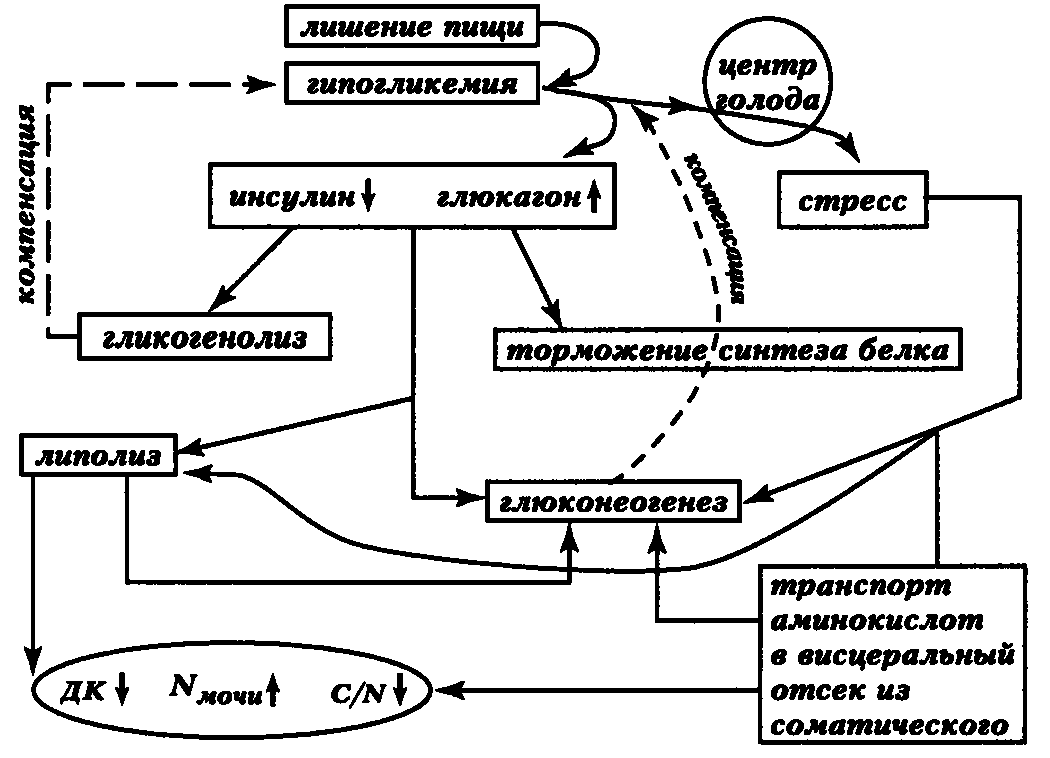
Рис. 6. Эндокринно-метаболические изменения в период экстренной адаптации при голодании. Сокращения: ДК—дыхательный коэффициент, Nмочи - общий азот мочи,
C/N—карбонурический коэффициент
Первое, что произойдет при прекращении поступления пищи,— снизится уровень глюкозы в крови, а это приведёт к снижению секреции инсулина и повышению выработки глюкагона клетками островков Лангерганса. При выраженном стрессе и при ускоренном голодании секреция инсулина может оставаться высокой, однако превалирует действие контринсулярных гормонов.
Повышение уровня глюкагона обусловит стимуляцию киназы фосфорилазы в гепатоцитах, что, в свою очередь, приведет к активации фосфорилазы и стимуляции гликогенолиза. Не следует также забывать и о таких эффектах глюкагона, как торможение синтеза белков на рибосомах.
Дыхательный коэффициент в первые часы голодания стремится к единице, карбонурический, как правило, не изменяется. Если пища не поступает, то запасы гликогена в основном истощаются через 12-24 часа и далее должны включиться иные механизмы обеспечения потребностей в энергии.
Главный среди них — глюконеогенез. Стимуляция этого процесса связана с голодным стрессом.
Голодание приводит к возбуждению центра аппетита в вентролатеральном гипоталамусе из-за гипогликемии, а также, в меньшей степени, в силу снижения притока аминокислот в кровь. Играет роль и отсутствие нервных импульсов от растянутых пищеварительных органов, а также понижение панкреатической секреции инсулина и дуоденальной продукции холецистокинина, стимулирующих в норме вентромедиальный гипоталамический центр насыщения.
При голодании энтериновая система активизирует выработку нейропептида Y, галанина и мотилина, стимулирующих центр голода. В дальнейшем высокая активность центра голода и низкая — центра насыщения поддерживается из-за снижения массы жировой ткани и пониженной продукции адипоцитами голодающего организма анорексигенного гормона кахексина, а также стимулятора чувства насыщения лептина (см. также «Устройство липостата» ниже). Таким образом, при голодании чувство голода достигает мучительной интенсивности и сохраняется в течение значительной части компенсированного периода голодания (пищевая доминанта — по А.А. Богомольцу). Затем его интенсивность ослабевает, вероятно, вследствие утомления центра (Л.Р. Перельман) или же в силу продукции при осложненном инфекциями голодании анорексигенных цитокинов.
Длительное возбуждение центра голода, как источник отрицательных эмоций, ведет к активации амигдало-лимбических образований, запускающих стресс (см. том I настоящего руководства, гл. 18). Гормоны стресса, вызванного голодом как стрессором,— прежде всего, АКТГ, катехоламины, глюкокортикоиды и вазопрессин — довершают стимуляцию гликогенолиза и активизируют глюконеогенез в печени.
Помимо того, что продолжающаяся секреция глюкагона стимулирует гормон- чувствительную липазу в гепатоцитах, что per se способствует возрастанию уровня окисляемых в гепатоцитах жирных кислот, липаза, расщепляющая триацилглицериды в липоцитах, активируется катехоламинами и глюкокортикоидами, а ключевые ферменты глюконеогенеза — глюкокортикоидами и глюкагоном.
АКТГ при стрессе действует системно и способствует липолизу в соматическом жире, а также тормозит синтез мочевины печенью, что влияет на усиление использования аминокислот, как энергетического материала. Под влиянием АКТГ в голодающем организме растёт продукция СТГ, оказывающего вместе с глюкокортикоидами, кате холаминами, вазопрессином и глюкагоном выраженный антиинсулиновый эффект.
СТГ опосредует свои анаболические эффекты через систему соматомединов, вырабатываемых печенью и другими тканями и органами. Но при голодании производство соматомединов (особенно, соматомедина С) резко снижается. Липолитический эффект СТГ, напротив, не связан с соматомединовым посредником. Все это обеспечивает катаболическое использование жиров и аминокислот из соматического пула и приоритетную поставку энергии в органы, располагающие инсулиннезависимыми транспортёрами глюкозы.
Глюкокортикоиды активизируют превращение глюкогенных аминокислот в глюкозу. Они тормозят синтез белка в скелетных мышцах, соединительной ткани, лимфоидных органах, коже и жировой ткани. Активизируется под влиянием кортикостероидов и транспорт аминокислот, прежде всего, аланина, из мышц в гепатоциты, в противоположность торможению их захвата в тканях соматического отсека (см. т. I данного руководства, стр. 554-556).
Вазопрессину, особенно важному регулятору первого периода голодания, принадлежит и еще одна способность — активизировать липолиз и захват жирных кислот печенью. Вместе с тем, считается, что этот нонапептид тормозит синтез кетоновых тел и противостоит непосредственному кето- генному эффекту такого гормона голодного организма, как глюкагон. Характерно, что кетоз при голодании развивается не в первые дни, а отсроченно, когда продукция вазопрессина падает (о чём можно судить по возрастающему в ходе голодания диурезу), а уровень глюкагона остается высоким.
Дата добавления: 2022-01-31; просмотров: 811;
