Химический анализ. Современные физические методы анализа
Одна из важнейших областей химии — химический анализ-связана с определением состава веществ и смесей. Качественный анализ устанавливает, из каких элементов состоят вещества или какие вещества входят в состав смесей, количественный-указывает точное содержание отдельных компонентов. Лабораторный анализ органических и неорганических веществ осуществляется различными методами.
Анализ неорганических соединений. Качественный анализ неорганических соединений обычно проводят полумикрометодом, беря небольшие пробы веществ-значительно меньше 1 г. Сначала химик исследует образец твердого вещества, получая общую предварительную информацию о его составе. Для этого используется, например, нагревание, которое вызывает изменение окраски вещества, возгонку или выделение газа. Затем вещество переводят в раствор, куда добавляют различные химические реагенты, наблюдая за изменением окраски, выделением газов или выпадением осадков.
Ионы металлов путем систематического анализа подразделяют на «аналитические группы» в зависимости от того, с какими реагентами растворимые соли металлов образуют нерастворимые осадки. Полученные осадки затем разделяют и распознают отдельные элементы с помощью специфических реакций.
Количественный анализ неорганических соединений осуществляется либо объемными, либо весовыми методами. При объемных методах исследуют реакции растворов известной концентрации, так называемых «стандартных растворов», с растворами анализируемого вещества. После приготовления стандартного раствора проводят титрование: один раствор медленно по каплям добавляют к другому до прекращения реакции. Зная концентрацию и объем израсходованного раствора, вычисляют содержание анализируемого вещества.
При весовых методах готовят раствор образца известной массы. Раствор вводят в реакцию с выбранным реагентом так, чтобы анализируемое вещество полностью выделилось в виде осадка, обычно нерастворимого в воде. Осадок-он должен быть совершенно чистым-отделяют, после высушивания взвешивают и по его массе рассчитывают количество анализируемого компонента.
Поскольку органические вещества могут существовать в виде изомеров, которые при одном и том же качественном и количественном составе обладают различным порядком связи, для их исследования необходимы методы анализа, позволяющие найти этот порядок.

При использовании метода полумикроанализа реакции проводят в пробирках небольшого объема, а центрифугирование осадков в конических пробирках. Растворы в этих пробирках перемешивают стеклянными палочками. Растворы сохраняют в склянках с пипетками, каждая из которых снабжена «капельницей». Во избежание разбрызгивания и «выбрасывания» растворов из пробирок при нагревании их помещают в маленькие водяные бани. Упаривание растворов досуха производят в миниатюрных тиглях. Для обнаружения газов на пробирки обычно надевают колпачки.

Температура плавления является одной из важных характеристик органических соединений. Ее можно определять с помощью автоматического устройства, изображенного на рисунке
Анализ органических соединений. Обнаружение элементов, входящих в состав органического вещества, производят методом последовательного исключения одного элемента за другим. Углерод и водород всегда присутствуют в органическом веществе, поэтому их качественное обнаружение проводят крайне редко. Существуют различные тесты, позволяющие установить наличие в органических соединениях тех или иных элементов. Примером может служить сплавление вещества с натрием по Лассеню, что позволяет установить наличие азота, галогенов (хлора, брома и йода) и серы. Зная качественный состав вещества, химик может отнести его к одному из основных классов. Далее проводятся специфические реакции на функциональные группы, характерные для определенных классов веществ. На основании этих реакций устанавливают строение анализируемого вещества.
Количественный анализ органического вещества также включает определение его элементного состава. Количество углерода и водорода находят, подвергая навеску вещества известной массы количественному окислению и определяя массу образующихся при этом двуокиси углерода и воды. Далее разными способами определяют количественное содержание элементов, входящих в его состав.
Эти данные позволяют вычислить процентный состав вещества и установить его простейшую (эмпирическую) формулу. Молекулярную формулу находят, сравнивая значения установленной молекулярной массы и молекулярной массы, соответствующей эмпирической формуле. Для определения молекулярной массы часто используют тот факт, что физические свойства раствора исследуемого вещества отличны от свойств исходного растворителя. При этом понижение упругости паров над раствором, повышение температуры его кипения и понижение температуры его замерзания пропорциональны мольной концентрации (выраженной в мольных соотношениях) растворенного вещества в растворе. Концентрация растворенного соединения влияет также на величину осмотического давления, вязкость растворов, на рассеяние света в них. Тщательные измерения какого-либо из этих параметров позволяют вычислить молекулярную массу. Теперь химик располагает достаточными данными, чтобы завершить анализ.
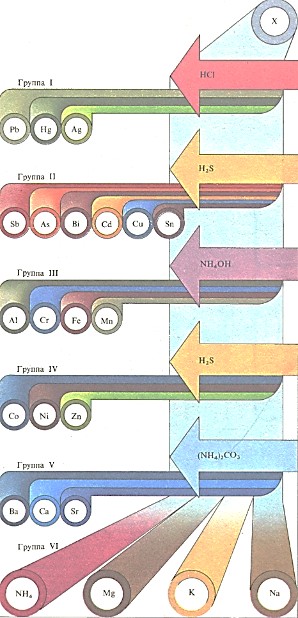
При качественном анализе ионы металлов идентифицируют, подразделяя их на «аналитические группы» с помощью специфических реакций осаждения. Сначала раствор анализируемого вещества обрабатывают разбавленной соляной кислотой. Металлы, хлориды которых нерастворимы в воде,-свинец, ртуть и серебро составляют I аналитическую группу. Если через солянокислый раствор пропустить газообразный сероводород, то выпадают осадки сульфидов металлов, образующих II группу,-сурьмы, мышьяка, висмута, кадмия, меди и олова. Добавление раствора аммиака к солянокислому раствору вызывает выпадение осадка гидроксидов металлов, входящих в III группу,- алюминия, хрома, железа и марганца. К IV группе относят металлы, сульфиды которых осаждаются из щелочного раствора при пропускании через него сероводорода,-кобальт, никель и цинк. Добавление карбоната аммония к остающемуся после этого раствору вызывает осаждение карбонатов бария, кальция или стронция, образующих V группу. VI аналитическая группа включает магний, натрий и калий, а также «металлоподобный» ион аммония, остающиеся в растворе после удаления всех остальных ионов металлов. Качественный анализ устанавливает только присутствие тех или иных ионов металлов, но не их количественное содержание.
Современные физические методы анализа. Методы хроматографии основаны на том, что различные вещества диффундируют или абсорбируются на отдельных поглотителях с разной скоростью. Каждое вещество обладает специфическим, характерным только для него спектром поглощения, на этом построены спектроскопические методы анализа. Спектры получают, возбуждая атомы, ионы или молекулы и наблюдая возникающее при этом излучение с помощью призм или дифракционных решеток.
При масс-спектроскопии образец вещества бомбардируют электронами относительно низкой энергии, при этом образуется ряд положительных ионов. Частицы, имеющие одно и то же отношение массы к заряду, фокусируются в пучки электромагнитным полем и регистрируются фотографическими или электрометрическими методами. Частица с наибольшим отношением массы к заряду соответствует иону молекулы. Таким образом этот метод дает возможность измерить молекулярную массу соединения. Исследование же осколков, образующихся при фрагментации молекулы, позволяет определить молекулярное строение соединения.
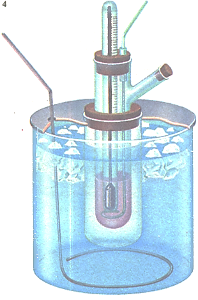
Молекулярная масса вещества может быть определена по понижению температуры замерзания раствора. Температура замерзания раствора вещества ниже, чем у чистого растворителя. Молекулярной константой понижения температуры замерзания называют величину понижения для раствора, содержащего 1 моль растворенного вещества на 100 г растворителя. Это слишком большая концентрация, поэтому обычно используют более разбавленные растворы, а величину названной константы вычисляют с учетом пропорциональной зависимости. Наиболее удобным растворителем служит вода.
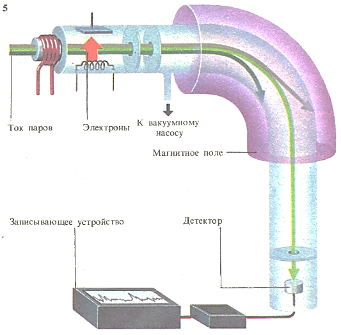
Масс-спектрометрия позволяет различать атомы с очень близкими массами. Атомы в образце паров вещества ионизируют, бомбардируя их электронами; образующиеся при этом положительные ионы ускоряют, пока все они не достигнут постоянной скорости. В сильном магнитном поле ионы испытывают отклонение: легкие- значительное, более тяжелые - небольшое. Поле регулируют таким образом, чтобы ионы с одинаковой массой попадали в одно и то же место регистрирующего устройства движущейся фотопластинки или электрометра с записывающим устройством
Дата добавления: 2022-01-31; просмотров: 676;
