Химические реакции. Типы реакций
В замкнутом сосуде сжата смесь воздуха с парами органических веществ, главным образом углеводородов. В молекулах углеводородов атомы углерода связаны между собой и с определенным числом атомов водорода. Если теперь через смесь пропустить электрический разряд, то тотчас же связи между атомами углерода и между атомами углерода и водорода разорвутся и возникнут новые связи-между этими атомами и атомами кислорода воздуха. В результате произойдет взрыв, и химическая реакция закончится. Подобные реакции происходят во множестве ежедневно и повсюду в мире при работе автомобильных и других двигателей внутреннего сгорания.
Молекулярная энергия. Химик исследует, как реагируют между собой отдельные вещества: насколько быстро они вступают в реакцию, что получается в результате ее и что необходимо для ее возникновения.
Почему, например, достаточно искры, чтобы началась реакция между углеводородами, содержащимися в нефтепродуктах, и кислородом, и почему никакими искрами нельзя вызвать горение выхлопных газов, в состав которых входят двуокись углерода и пары воды?
Почему искра вызывает взрыв смеси паров горючих веществ с воздухом, но, попав, скажем, на этот лист бумаги, приведет всего лишь к легкому тлению?
Ответить на эти вопросы мы сможем, если рассмотрим энергию различных молекул. В природе молекулы встречаются гораздо чаще, чем свободные атомы, поскольку образование химической связи сопровождается высвобождением энергии и возникающие соединения оказываются более устойчивыми. Это относится и к химическим реакциям. Если реакция протекает самопроизвольно, то, как правило, при этом высвобождается энергия и образуются более устойчивые молекулы.
Теоретически вода может вступить в реакцию с двуокисью углерода с образованием углеводородов и кислорода. Однако, поскольку молекулы углеводородов и кислорода энергетически менее устойчивы, чем молекулы воды и двуокиси углерода, потребуется колоссальное количество энергии, чтобы заставить прореагировать названные исходные реагенты. Пожалуй, еще более выразительным примером здесь может служить коррозия металлов. Соединения многих металлов, например оксиды или сульфиды, более устойчивы, чем сами чистые металлы. Используя процессы, требующие затрат энергии, ученые смогли выделить из руд чистые металлы. Однако если изделия из металлов оставить незащищенными, то они начинают корродировать, т. е. самопроизвольно образуются соединения, подобные оксидам (ржавление железа) или сульфидам (потускнение и почернение серебряных изделий), которые более устойчивы, чем чистые металлы.
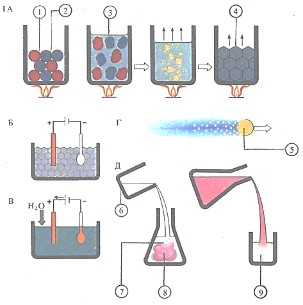
Нагревание (А) сульфата алюминия (1) с сульфатом калия (2) не вызывает химической реакции. Однако если раствор этих веществ (3) нагреть и выпарить, то из него выделяются кристаллы квасцов (4). Сухие кристаллы медного купороса (Б) не проводят электрического тока, но в их водном растворе может протекать процесс электролиза (В). Металлы могут реагировать с жидкостями (Г): кусочек натрия (5) плавится в воде и, выделяя из воды водород, «бегает» по ее поверхности. Растворы и другие жидкости легко вступают в реакцию (Д): если раствор фенолфталеина (6) добавить к раствору щелочи (7), то появится розовая окраска (8). При добавлении этого раствора к раствору кислоты окраска исчезает (9).
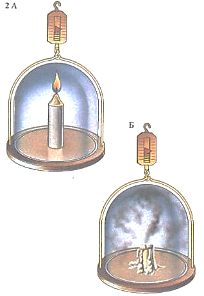
В химических реакциях вещества не создаются из ничего и не исчезают бесследно. Этот закон сохранения массы можно проиллюстрировать классическим опытом Внутрь подвешенного на весах герметичного стеклянного сосуда помещают горящую свечу (А). По окончании опыта вес сосуда с его содержимым (Б) остается неизменным, хотя часть свечи, состоящей в основном из углерода и водорода, «исчезает», превращаясь в летучие продукты (воду и двуокись углерода). Закон сохранения массы, установленный в конце XVIII в., позволил производи 1Б количественную оценку химических процессов
Типы реакций. Некоторые химические реакции происходят самопроизвольно. Чтобы началась реакция между нефтепродуктами и кислородом воздуха, необходима искра, поскольку на пути превращения исходных веществ в продукты реакции существует некоторое переходное состояние с более высокой энергией, чем исходные вещества. Чтобы молекулы исходных веществ смогли преодолеть этот энергетический барьер, им необходимо сообщить некоторый запас энергии-энергию активации. Причем, чем больше энергии выделяется в результате реакции, тем большее количество молекул в состоянии преодолеть этот барьер, и если реакция протекает достаточно быстро, то в результате происходит взрыв. Энергию, необходимую для начала реакции, можно получать из разных источников.
Чаще всего для этого используют нагревание, однако иногда вызвать реакцию могут и другие виды энергии, скажем световая.
Существует бесчисленное множество различных типов реакций, но все их можно разделить на несколько простых категорий. В некоторых реакциях одно вещество за счет перемещения и изменения связей превращается в другое (перегруппировка). В других-исходное вещество распадается на две или несколько составных частей (разложение) или, наоборот, из нескольких веществ получается одно новое (соединение). Однако значительно чаще в ходе реакции возникает несколько новых веществ.

Струя чистого этилена горит светящим диффузным пламенем (А). Если усилить приток воздуха, то в факеле пламени обнаруживаются три отчетливые зоны: внутренняя конусообразная зона еще не горящего этилена, сине-зеленый слой реагирующих предварительно смешанных газов и внешняя конусообразная зона, где частично окисленные продукты сгорают диффузным пламенем (Б). При добавлении окиси азота окраска пламени изменяется, но в нем также заметны зоны (В). Однако, если еще добавить кислород, то диффузный слой исчезает (Г)
Что необходимо для протекания реакции. Если в реакции участвует только одно вещество, активное состояние достигается в результате того, что молекула поглощает энергию, достаточную, чтобы вызвать в ней изменения. Так, когда зрительный пигмент родопсин, содержащийся в сетчатке глаза, поглощает свет, один из электронов молекулы родопсина получает дополнительную энергию и молекула скачком переходит в новое энергетическое состояние. В результате форма ее изменяется-образуется новый геометрический изомер.
Если в реакции участвуют различные вещества, то молекулы должны не только преодолеть энергетический барьер, но и прийти в столкновение друг с другом. Поэтому некоторые реакции происходят при повышенном давлении (например, в автомобильных двигателях), ибо, чем ближе молекулы находятся друг к другу, тем чаще столкновения между ними.
Другой путь увеличить вероятность столкновения молекул - использование катализаторов. Они ускоряют реакции, понижая энергетический барьер активации. Другие катализаторы (ингибиторы)-их можно назвать отрицательными-замедляют реакции или даже вообще препятствуют их протеканию.
В наше время химики используют разнообразные методы, позволяющие следить за протеканием реакций и исследовать их продукты. К числу новейших методов относятся ядерный магнитный резонанс и мёссбауэровская спектроскопия.
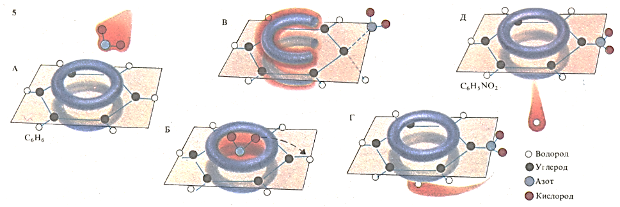
Реакция нитрования бензола протекает в несколько стадий. Сначала вводимая группа, приблизившись к молекуле бензола (А), образует с ней непрочную связь (Б). Затем происходит перегруппировка с образованием неустойчивого, богатого энергией промежуточного соединения (В), которое превращается в комплекс (Г). Реакция заканчивается отщеплением уходящей группы (Д).
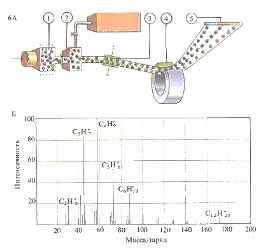
В ионизационной камере (1) масс- спектрометра (А) происходит отрыв электронов внешних слоев от молекулы. Положительные ионы попадают в соседнюю вакуумную камеру (2) и фокусируются электрическим (3) и магнитным (4) полями. Идентификация ионов по их отклонению осуществляется, например, с помощью фотопластинки (5). Молекулы, подобные молекулам n-додекан а, расщепляются при этом на отдельные фрагменты, которые дают различные «пики» (Б). По положению этих пиков можно с высокой точностью установить строение исходной молекулы.
Дата добавления: 2022-01-31; просмотров: 688;
