Электрохимия. Химические реакции. Электролиз
Электроны – отрицательно заряженные частицы-являются составной частью любого атома, и взаимодействие электронов различных атомов представляет собой основное содержание химии. Поскольку электрический ток есть не что иное, как поток электронов, не удивительно, что химия и электричество тесно связаны между собой.
Ранние исследования. Исследования в области химии и электричества шли рука об руку задолго до того, как стало что-либо известно о существовании электронов. В XVIII в. было получено много интересных сведений о статическом электричестве, что, в частности, привело к созданию «лейденской банки» и громоотвода (молниеотвода). В конце XVIII в. итальянский физиолог Луиджи Гальвани обнаружил, что мышца лапки лягушки сокращается, если одновременно к ней прикасаются два разных металла. Так был открыт электрический ток. В 1795 г. другой итальянец, Алессандро Вольта (1745-1827), показал, что это «животное» электричество может быть получено и без живой материи. Он разделил две пластины из разных металлов тканью, смоченной раствором соли, изготовив таким образом первую электрическую басарею. В последующие пять лет, работая уже в Англии, он обнаружил, что электрический ток от такой батареи разлагает воду на газообразные водород и кислород. Это положило начало электрохимии. Вскоре электрические батареи стали существенной частью оборудования любой химической лаборатории, что привело к новым открытиям. Так, в первом десятилетии XIX в. Гемфри Дэви получил электролизом металлические натрий и калий.

Алессандро Вольта сконструировал в 1800 г. «искусственный электрический орган» - устройство, действие которого, по его мнению, было аналогично действию специфического органа электрического угря, вырабатывающего электричество. В этом устройстве каждая пара чередующихся цинковых и медных дисков была отделена друг от друга слоем ткани, пропитанной рассолом.
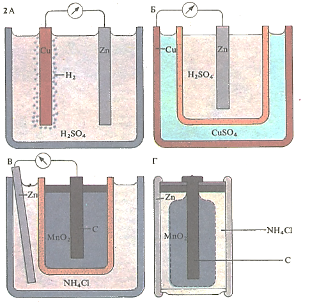
Гальванический элемент Вольта (А) состоит из сосуда с серной КИСЛОТОЙ (H2S04), в которую погружены медная (Си) и цинковая (Zn) пластины. Если замкнуть цепь, то по ней потечет электрический ток: ионы цинка переходят в раствор, а на медной пластине происходит выделение водорода (Н2). В элементе Даниэля (Б) цинковая пластина и раствор сульфата цинка находятся в пористом сосуде, помещенном в медный сосуд с раствором сульфата меди (CuS04). В элементах Лекланше (В) и «сухом» элементе (Г) графитовый стержень помещен в раствор или пасту хлорида аммония, содержащую взвесь диоксида марганца (Мп02).
Химические реакции. Рассмотрим, например, цинк. В основном при образовании соединений цинка каждый его атом теряет 2 электрона, и возникает положительный ион цинка с зарядом + 2 (Zn2 + ). Металлы отличаются по своей способности отдавать электроны. Если цинковую пластину поместить в раствор сульфата меди (содержащий ионы Сu2+), то электроны перейдут от цинка к ионам меди и цинк превратится в сульфат цинка (содержащий ионы Zn2 + ), а сульфат меди-в металлическую медь.
Если атом элемента приобретает электроны, образуя отрицательные ионы, то говорят, что элемент восстанавливается; если же атом теряет электроны, образуя положительные ионы, то говорят, что элемент окисляется. Реакции, в которых процессы восстановления и окисления взаимно компенсируют друг друга, как, например, при взаимодействии цинка с сульфатом меди, называют окислительно-восстановительными.
Используя электрический ток, можно добиться, чтобы процессы окисления и восстановления протекали раздельно. С этой целью электрическую батарею делают таким образом: в один сосуд помещают металлический цинк и раствор сульфата цинка, в другой-металлическую медь и раствор сульфата меди. Если эти растворы соединить влажной пористой пластиной, а металлические пластины проволокой, то по проволоке пойдет электрический ток. В каждой из двух частей такого прибора протекает лишь половина реакции. Соединив эти части проводниками, мы получим гальванический элемент.
Электрическое напряжение, создаваемое гальваническим элементом, зависит от химического состава электродов и электролита. Логично и другое положение: одно и то же количество электронов должно вызывать одинаковые количественные изменения в реагирующем веществе. Количественные соотношения в реакциях, происходящих под действием электрического тока, были установлены в XIX в. Майклом Фарадеем. Электрический ток часто используют для выделения и электроосаждения металлов, а также получения реакционноспособных электроотрицательных элементов типа хлора или фтора.

В юности Майкл Фарадей (1791-1867)посещал лекции Гемфри Дэви в Королевском институте в Лондоне. Свою деятельность он начал ассистентом Дэви. Впоследствии стал профессором химии Королевского института и проработал в этой должности свыше 30 лет. Большинство работ Фарадея относится к физике - в частности, он занимался электромагнитной индукцией. Фарадей установил соотношения между количеством электричества, прошедшего через раствор, и количеством разложившихся при этом веществ, поэтому его считают основоположником теории Электрохимии.
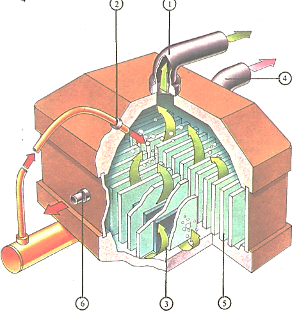
Металлы и неметаллы, атомы которых легко приобретают или теряют электроны, часто получают с помощью электролиза из их ионных соединений. Например, хлор (1) можно получить электролизом раствора хлорида натрия (2) на графитовых анодах (3). При этом на катодах (5) в результате электролиза воды выделяется водород (4), а в растворе остаются ионы натрия и гидроксил-ионы, т.е. образуется раствор гидроксида натрия (6). В промышленных установках катоды и аноды разделены перегородками, препятствующими взаимодействию водорода и хлора, ведущего к образованию хлористого водорода.
Электролиз. В ряде случаев образование в процессах электролиза тех или иных веществ зависит от конкретных условий электролиза. Если электролизу подвергнуть расплавленный хлорид натрия, то на одном электроде образуется металлический натрий, а на другом выделяется газообразный хлор. Однако, если в качестве электролита взять раствор того же хлорида натрия и анод сделать графитовым, а катод-железным, то на электродах образуются газообразные водород и хлор, в растворе же после электролиза останется гидроксид натрия.
Ионы различных элементов могут быть положительными (катионы) или отрицательными (анионы). В растворе, который подвергается электролизу, катионы притягиваются к катоду, анионы-к аноду. Если алюминиевый анод погрузить в раствор кислоты, то на его поверхности в результате окисления образуется очень тонкий слой оксида алюминия. Такое анодное окисление защищает поверхность алюминия от коррозии и широко используется при изготовлении разнообразных изделий.
В повседневной жизни мы повсюду сталкиваемся с реакциями окисления. К ним, например, относится сгорание топлива (нефтепродуктов) в автомобильных двигателях. Можно сделать так, чтобы энергия реакции окисления превращалась не в тепло, а непосредственно в электрический ток. Подобное происходит в топливном элементе. Теоретически такие элементы должны значительно эффективнее преобразовывать энергию, чем тепловые машины. Однако пока стоимость топливных элементов слишком высока, поэтому они находят ограниченное применение лишь в некоторых специальных областях.
К числу промышленных применений электрохимии относится металлизация изделий путем электролиза. Так, с помощью электроосаждения декоративные покрытия из серебра и золота наносятся на ювелирные изделия, а покрытия из хрома-на стальные изделия (обычно на предварительно нанесенные тонкие слои меди и никеля), что повышает их устойчивость к коррозии.
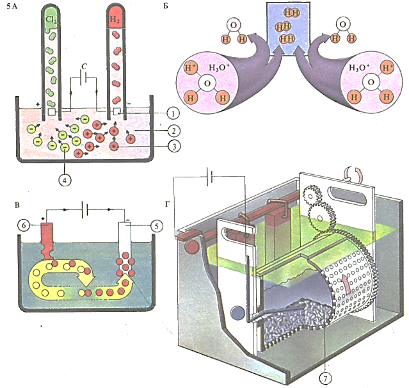
При электролизе ток проходит (А) между платиновыми электродами (1) через разбавленный раствор соляной кислоты (2). Положительно заряженные катионы (3) двигаются к катоду, а отрицательно заряженные анионы (4) - к аноду. Ионы водорода, соединяясь с молекулами воды, образуют ионы гидроксония (НзО +). Достигнув катода, каждый из ионов гидроксония присоединяет по электрону, образуя водород (Б). При электроосаждении меди (В) медь из раствора сульфата меди (электролит) осаждается на поверхности предмета (5), покрываемого метал лом, а медь, из которой изготовлен анод (6), переходит в раствор. Современные промышленные электролизеры (Г) позволяют одновременно металлизировать множество мелких изделий (7)
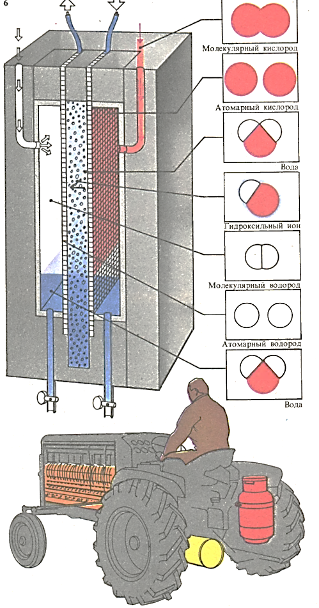
Топливный элемент, как и гальванический, вырабатывает электроэнергию за счет химической реакции. В одном из простейших элементов в качестве «топлива» используются водород и кислород. В таком элементе водород находится в пространстве, окруженном очень гонкой мембраной, насыщенной водой. Последняя пропускает ионы, но задерживает нейтральные атомы и молекулы. Электроды представляют собой металлическую сетку, поверхность которой покрыта платиной. Из газовых камер к сетке поступают молекулярные водород и кислород. На поверхности одной платиновой сетки кислород образует гидроксил-анионы. Проходя сквозь мембрану, они реагируют с ионами водорода, образующимися на другой платиновой сетке из молекулярного водорода - в результате образуется вода. Электроны, освобождающиеся из водорода на второй платиновой сетке, по электрической цепи поступают на первую сетку, где кислород превращается в гидроксил-анионы.
Дата добавления: 2022-01-31; просмотров: 738;
