Вирус иммунодефицита человека (ВИЧ)
В середине 1981 года в США у нескольких молодых гомосексуалистов были зарегистрированы случаи пневмонии, вызванные резидентом - пневмоцистой. В этот же период у 28 человек с такой же сексуальной ориентацией обнаружили саркому Капоши. Саркома Капоши - это многоочаговая опухоль эндотелиального происхождения, поражающая кожу, слизистые оболочки, кишечник, легкие, лимфоузлы.
Общим во всех этих случаях было обнаружение иммунного дефицита, связанного с разрушением лимфоцитов и макрофагов.
Примерно через год после этого американский исследователь Р. Галло высказал предположение, что состояние иммунного дефицита вызвано особым вирусом, относящимся к группе ретровирусов.
В 1983 году французский вирусолог Л. Монтанье сообщил об обнаружении этого вируса, получившего название Human Immunodeficiency Virus (вирус иммунодефицита человека - ВИЧ).
Характеристика ВИЧ. Вирус иммунодефицита человека относится к сложным («одетым») вирусам диаметром 100-120 нм (рис. 12).
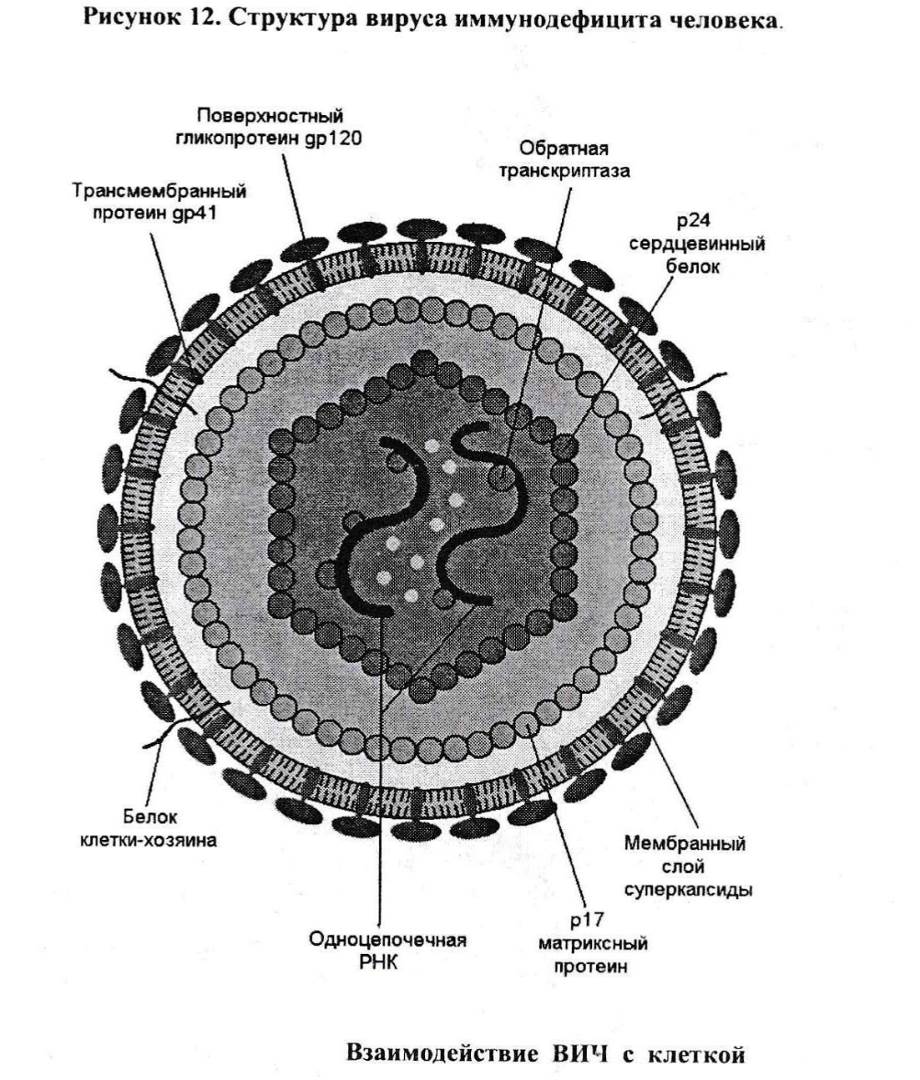
Геном вируса представлен двумя отдельными плюс-цепочками РНК, содержащими, как полагают, одинаковую генетическую информацию.
Геном заключен в две оболочки. Одна из них (core - сердцевинная) представлена протеином р24, другая - матриксная - протеином р 17.
В комплексе с вирусной РНК находится ряд ферментов, из которых наиболее важным является обратная транскриптаза (reverse transcriptase). Отсюда название этой группы вирусов – ретровирусы.
Самая поверхностная оболочка вируса - суперкапсида - формируется из цитоплазматической мембраны клетки-хозяина и включает в свой состав два вирусоспецифических белка - гликопротеина - gpl20 и gp41. В последнее время выяснилось, что в составе суперкапсиды вируса есть протеин клетки, в которой происходила репликация вируса. Роль этого протеина остается неясной, но вряд ли его включение в состав вируса является артефактом.
Нельзя сказать, что все детали репродукции ВИЧ в клетке известны. Вместе с тем, основные этапы этого процесса изучены достаточно подробно.
Вирусы иммунодефицита человека взаимодействуют с клетками, имеющими рецептор CD4. Основную массу таких клеток представляют Th - лимфоциты, которые и являют собой главный «объект нападения» для ВИЧ. Рецептор CD4 представлен и на поверхности некоторых тканевых макрофагов и моноцитов но, возможно, в меньшем количестве. Вполне вероятно , что макрофаги, если и осуществляют репродукцию ВИЧ, то несколько иначе, чем Th-клетки. В связи с этим будет правильным рассмотреть цикл репродукции ВИЧ на модели его взаимодействия с Th-клеткой (Рис. 13).
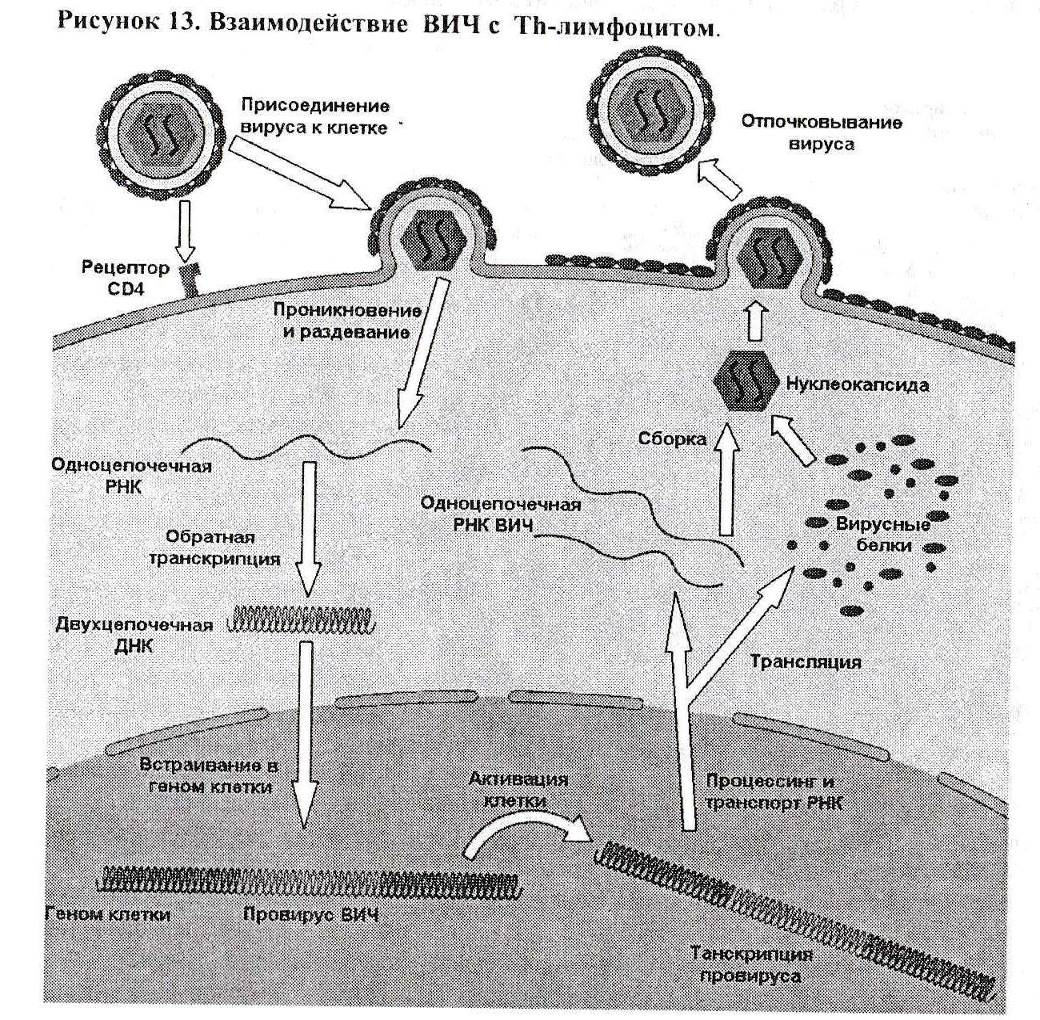
Специфичность взаимодействия ВИЧ с клеткой обусловлена контактом его антигена gpl20 с С04-рецептором клетки. После прикрепления вириона его gp4l -протеин индуцирует слияние мембранного компонента суперкапсиды с цитоплазматической мембраной клетки. В результате нуклеокапсид вируса оказывается в клетке. Белковые оболочки вируса (р17 и р24) разрушаются («раздевание вируса»), и освобождается вирусный геном с ферментами.
Обратная транскриптаза начинает синтез ДНК на матрице вирусной РНК. После синтеза двухцепочечной ДНК эта молекула (ДНК-реплика) с помощью вирусного фермента интегразы встраивается в клеточный геном (провирус). Встраивание это может происходить в разные сайты клеточного генома многих молекул провируса.
В таком положении «провируса» ДНК вируса находится некоторое время как бы в «неактивном» состоянии: информация с нее не считывается, и вирусные компоненты в клетке не воспроизводятся. Сколько времени может продолжаться такое «неактивное» состояние — не ясно. Некоторые исследователи полагают, что это может продолжаться сколь угодно долго до момента стимуляции лимфоцита каким-либо антигеном.
В то же время, в модельных опытах было показано, что с момента антигенной стимуляции в лимфоците начинается процесс реализации вирусной информации, включающий:
1. Синтез плюс-цепей РНК на матрице провируса (траскрипция).
2. Синтез вирусных белков на матрице плюс-цепи РНК (трансляция).
3. Внутриклеточное формирование вирионов из плюс-цепей РНК с вирусными ферментами и двух оболочек из р24 и р 17.
4. Отпочкование вирионов от клетки путем «одевания» вируса в мембрану клетки (суперкапсида) с включенными в ее состав вирусными белками gp 120 и gp41, а также с какимто клеточным белком.
Весь этот процесс с момента антигенной стимуляции занимает менее двух дней. Производящие вирус лимфоциты погибают. Из них выделяется 108 - 1010 вирусных частиц, которые инфицируют новые клетки.
Поскольку, видимо, антигенная стимуляция достаточно большого числа лимфоцитов не такой уж частый процесс, присутствие ВИЧ в организме может долгие годы не вызывать каких- то клинических проявлений.
Однако с течением времени и нарастанием процесса разрушения иммунной системы развивается то, что носит название СПИД - синдром приобретенного иммунодефицита.
В этот период снижение функций иммунной системы, нарушение связей между ее элементами делает организм беззащитным перед населяющими его резидентами, каждый из которых готов проявить свою оппортунистическую сущность. Закономерно и развитие в этот период злокачественных процессов (саркома Капоши). Использование самого современного лечения в этой стадии может только отсрочить безрадостный конец.
Есть ли более оптимистические перспективы? Первый вопрос, который возникает в связи с предыдущим пессимистическим заключением, может звучать так.
«Почему сам организм не борется с вирусом?» Организм, конечно, борется сначала. Уже примерно через месяц после инфицирования появляются антитела к gpl20 и gp24. Их уровень остается довольно высоким на протяжении нескольких лет. Однако они не предотвращают процесса заражения вновь появляющихся лимфоцитов. Почему так происходит? Если есть антитела к gpl20, то, взаимодействуя с этим антигеном вируса, они должны предотвращать контакт вируса с клеткой. Может, частично так и происходит, но другая часть вирусов (а их 108-1010 одномоментно в организме) ускользает от антител и инфицирует новые лимфоциты. Это «ускользание», как полагают, связано с тем, что под действием «иммунного пресса» селекционируются варианты вируса с измененным антигеном gpl20. С этим антигеном антитела уже не соединяются. Это мнение очень распространено, но тоже вызывает вопрос: “Если gpl20 у вируса изменен, то почему же он все- таки взаимодействует с неизменным рецептором клетки CD4?”. На этот вопрос возможны, как минимум, два ответа.
1. Поступление ВИЧ в Th зависит не только от взаимодействия gpl20 с CD4, существуют и другие варианты этого процесса (вспомним о наличии в суперкапсиде ВИЧ какого-то клеточного белка).
2. Регистрируемые изменения gpl20 не столь существенны, чтобы изменить специфичность его соединения с рецептором CD4, и, в то же время, существенны для взаимодействия gpl 20 с антителами.
Может быть и другой, более «глобальный» вывод. ВИЧ вызывает поражение самой иммунной системы, и в результате этого что-то в ней меняется таким образом, что антитела теряют свою протективность.
То, что вирус в этом «замешан»,- не подлежит сомнению в свете другого факта. В соответствующем разделе пособия говорилось , что в противовирусном иммунитете существенную роль играют Тс -лимфоциты, разрушающие пораженные вирусом клетки. Однако чтобы Тс проявил цитотоксическую активность, на поверхности клетки-мишени должны быть представлены вирусные белки в комплексе с белками МНС1. Вирусные белки на поверхности Th, зараженного ВИЧ, есть, а вот МНС1 - нет. Оказалось, это связано с наличием у ВИЧ особого гена - tat, каким-то образом блокирующего синтез МНС1 в клетке.
Второй вопрос, который также правомерен в том плане, что ни одного больного СПИДом пока не удалось спасти.
Направления лечения и специфической профилактики СПИДа. Основными направлениями медикаментозного воздействия на этиологические и патогенетические механизмы развития ВИЧ-инфекции, которые разрабатываются в настоящее время являются:
Во-первых, воздействие на проникновение и воспроизведение вируса в клетке,
Во-вторых, коррекция нарушенных механизмов иммунного ответа на уровне цитокиновой регуляции,
В-третьих, лечение вторичной (оппортунистической) инфекции в случае развёрнутой клинической картины инфекции (собственно СПИДа).
Наряду с этим, ведутся разработки вакцинных препаратов против ВИЧ. Однако, эффективной вакцины пока не получено.
Методами химического синтеза и генной инженерии разрабатываются следующие группы препаратов, которые в настоящее время проходят клиническую апробацию в разных странах:
1. Ингибиторы обратной транскриптазы (нуклеозидные ингибиторы - азидотимидин, абакавир, диданозин, залцитабин, ламивудин, ставудин, ненуклеозидные ингибиторы - дилавирдин, ифавиренц, невирапин)
2. Ингибиторы ВИЧ-протеазы (ампренавир, индинавир, криксиван, ритонавир, норвир)
3. Ингибиторы репликации (ацикловир)
4. Комбинированные анти-ВИЧ препараты (комбивир)
5. Цитокины (ронколейкин)
6. Препараты интерферона (реоферон, лейкинферон)
7. Иммуномодуляторы и интерфероногены (арбидол)
Наиболее рациональным в этом плане является блокирование функций обратной транскриптазы. С этой целью используется введение в организм аналогов нуклеотидов, наиболее эффективным из которых является азидотимидин. Когда это соединение попадает в клетку, то оно включается в растущую цепь ДНК вместо обычных нуклеотидов и блокирует действие обратной транскриптазы. Синтез вирусной ДНК прекращается.
Вместе с тем показано, что только комбинированная терапия, направленная на блокаду репродукции ВИЧ в двух узловых точках - активность обратной транскриптазы и ВИЧ-протеаз, а также использование других препаратов, - обеспечивает максимальный клинический эффект, достоверное снижение вирусной нагрузки, улучшение качества и продолжительности жизни пациентов.
Несмотря на это, полностью излечить больных не удается. Кроме того, многие из основных препаратов далеко не безразличны для организма и могут вызвать развитие тяжелейшей анемии и агранулоцитоза.
Дата добавления: 2022-01-31; просмотров: 726;
