Основы физики и химии для дайверов
Главными категориями физики и химии, безусловно, являются две формы существования материи: «вещество» и «энергия». Это действительно так, независимо от того, являетесь ли вы космологом, изучающим момент зарождения Вселенной и времени, или дайвером, вычисляющим объем газа при увеличении давления втрое.
Материя.Материя - это все вещество, из которого состоит Вселенная. За исключением результатов ядерных реакций (которые могут переводить материю в энергию) материя не может быть создана из ничего или уничтожена полностью. Она лишь может переходить из одной формы в другую. Различные вещества могут объединяться, образуя новые вещества с другими свойствами, и в то же время некоторые вещества могут распадаться на составляющие. Вещество может изменять агрегатное состояние - переходить из твердого в жидкое и газообразное, и наоборот. Однако количество вещества при этих переходах никогда не изменяется — оно всегда остается постоянным, так как материя никогда не возникает из ничего и не исчезает- бесследно.
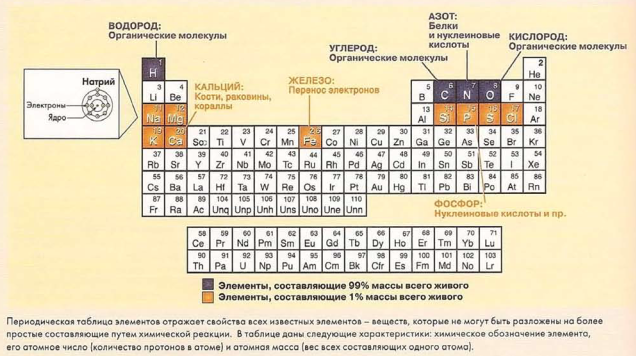
Виды вещества. Все вещество состоит из отдельных форм, называемых химическими элементами. Элемент - это вещество, которое не может быть разложено на еще более простые вещества путем химических реакций. Химический элемент — основная форма каждого химического вещества.

Применительно к дайвингу: Осознание различий между пилами химических веществ - это основа для понимания поведения веществ под водой. Это, например, ответ на вопрос, почему гелий не реагирует с другими веществами, что делает его пригодным для погружений на большую глубину в техническом дайвинге.
Возьмем, к примеру, воду. Вода не является химическим элементом, потому что вы можете разложить ее на более простые составляющие - кислород и водород. А вот кислород и водород - это химические элементы, поскольку никакая химическая реакция не в состоянии разложить их на еще более простые вещества. На самом элементарном уровне все вещества живой и неживой природы состоят из химических элементов в разных пропорциях и комбинациях.
На сегодняшний день химики и физики определили и окончательно утвердили существование более 100 химических элементов. Из них 90 встречаются в природе, в то время как остальные созданы искусственно в научных лабораториях. Образование новых химических элементов происходит, когда ученые проводят реакции по расщеплению атомного ядра и ускорению элементарных частиц, изменяя или разрушая тем самым естественный химический элемент. Когда это происходит, измененный элемент не может быть далее разложен на что-то более простое путем химических реакций, но и не сохраняет более при: сущих ему изначально свойств. Следовательно, по определению, он является новым химическим элементом.
Ядерные реакции могут переводить вещество в энергию, и это является одним из принципов атомной энергетики. Вы, конечно, слышали о знаменитом уравнении Альберта Эйнштейна:
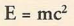
В его уравнении Е обозначает энергию, m - массу (вещество), а с2 — скорость света в квадрате. Поскольку скорость света в квадрате - очень большая величина, уравнение Эйнштейна показывает, что очень малое количество вещества при огромном ускорении переходит в колоссальное количество энергии. Это фундаментальный закон ядерной физики, работающий независимо от того, происходит ли такое ускорение в реакторе атомной подводной лодки или на Солнце, от которого зависит вся жизнь на Земле.
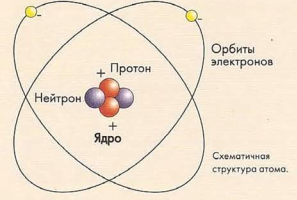
Элементы состоят из атомов. Атом (от греческого «atomos» - «неделимый») - это самая мельчайшая частичка вещества, которая все еще способна демонстрировать присущие только ему свойства. Атомы настолько малы, что если их укладывать один поверх другого, то понадобится несколько миллионов атомов, чтобы такой «столбик» мог достичь толщины этой страницы.
В свою очередь атомы состоят из более мелких составляющих (субатомных частиц), к которым относятся отрицательно заряженные электроны, положительно заряженные протоны и частицы, не имеющие электронного заряда - нейтроны. Положительно зараженные протоны и отрицательно заряженные электроны притягиваются друг к другу, что обеспечивает целостность атома. Поскольку общее количество протонов равно общему количеству электронов (за исключением ионизированных атомов, о которых мы расскажем далее), то атом в целом обладает нейтральным зарядом.
Нейтроны и протоны имеют приблизительно одинаковый размер и находятся в ядре (центре) атома, удерживаемые так называемой внутриатомной силой. Протоны придают ядру положительный заряд. Вокруг ядра движутся отрицательно заряженные электроны, значительно уступающие ядру в размерах, образуя орбитальное облако. Из-за высокой скорости, с которой электроны движутся по орбите, некоторые ученые называют атомы «маленькими пушистыми шарами».
Диаметр электронного облака в 100 000 раз превышает диаметр ядра. Так, если бы атом водорода обладал диаметром в 6 км, то его ядро было бы размером с апельсин. Электроны вращаются вокруг ядра по определенным слоям или орбитам. В зависимости от элемента на каждой орбите может находиться определенное число электронов. Мы вернемся к этому вопросу позже, когда будем обсуждать, как атомы взаимодействуют друг с другом, образуя более сложные формы материи.
Несмотря на то, что ядро ничтожно мало по сравнению с размерами атома, в нем сосредоточено до 99,9% массы атома. Это происходит из-за того, что масса протонов и нейтронов больше массы электронов приблизительно в 2000 раз. Общая масса частиц, составляющих атом, называется атомной массой. Помимо массы, другой характеристикой атома является количество протонов в ядре. Поэтому каждый элемент обладает атомным числом, которое представляет собой ничто иное, как количество протонов в ядре. Некоторые атомы одного и того же элемента обладают одинаковым количеством нейтронов, но разным количеством протонов. Такие разновидности одного и того же элемента называются изотопами.
Атомы могут соединяться друг с другом в молекулы разными способами. Молекулы, состоящие из разных элементов, называются соединениями или веществами. Молекула представляет собой мельчайшую частицу вещества, обладающую всеми его свойствами. Примером соединения является двуокись углерода (СО,). Каждая молекула двуокиси углерода состоит из одного атома углерода и двух атомов кислорода.
Иногда молекулы образуются из атомов одного и того же элемента. Например, два атома азота образуют молекулу азота - газа, входящего в состав воздуха. Вещества, которые состоят из атомов одного элемента, называются молекулярными элементами.
Соединения, как правило, обладают совершенно иными свойствами, чем отдельные элементы, из которых они состоят. Ярким примером такого соединения является вода. Обе ее составляющие - кислород и водород - в своем обычном состоянии являются газами, очень легко вступающими в химическую реакцию с другими веществами. Однако в соединении они образуют воду - очень устойчивую жидкость, обладающую свойствами, кардинально отличающимися от свойств образующих ее элементов.
Различие свойств соединений и свойств составляющих их компонентов характерно не только для соединений, образованных разными элементами. Поведение молекулярных элементов, таких как газообразный азот, может отличаться от поведения отдельных атомов того же элемента.
Атомы соединяются друг с другом в молекулы посредством химических связей. Процесс образования химических связей называется химической реакцией. Лишь атомы с совместимой атомной структурой могут образовывать химические связи. Совместимость атомов зависит от расположения электронов внутри него. Атомы, обладающие таким расположением электронов, которое позволяет им образовывать химические связи, называются реакционноспособными. Способность атомов вступать в химическую реакцию зависит от количества электронов, находящихся на внешней орбите атома. Если внешняя орбита заполнена, т.е. на ней находится столько электронов, сколько она может содержать, то атом не будет легко вступать в химическую реакцию. Такой атом называется устойчивым. Примерами наиболее устойчивых атомов могут служить инертные газы - гелий и неон. Технические дайверы и коммерческие водолазы иногда добавляют гелий в дыхательную смесь из-за его устойчивости (подробнее об этом мы расскажем позже).
Атомы, у которых на внешней орбите находится меньше электронов, чем она может содержать, более свободно вступают в химическую реакцию, но не со всеми элементами. По существу, атомы соединяются друг с другом в молекулы, чтобы заполнить внешнюю электронную орбиту. Это происходит путем образования ионных или ковалентных связей.
Ионная связь создается, когда один атом заимствует электрон у другого атома, чтобы заполнить свою внешнюю орбиту. В результате атом, который отдает электрон, становится положительно заряженным (поскольку он потерял отрицательно заряженный электрон), в то время как атом, который принял электрон, становится отрицательно заряженным (поскольку теперь в нем содержится электронов на один больше, чем протонов). Противоположно заряженные атомы притягиваются друг к другу.
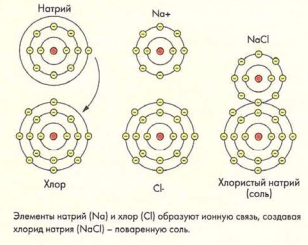
Примером ионной связи может служить обычная поваренная соль - хлорид натрия (NaCl). У атома натрия на внешней электронной орбите находится только один электрон, тогда как максимально она может содержать 11 электронов. У атома хлора, напротив, семь электронов почти полностью заполняют внешнюю орбиту, на которой всего могут находиться восемь электронов. Хлор принимает у атома натрия единственный электрон, находящийся на внешней орбите, заполняя таким образом свою внешнюю орбиту. Из-за этого у атома хлора становится на один электрон больше, чем протонов, и придает ему отрицательный заряд. Атом натрия, отдав электрон, теперь содержит протонов на один больше, чем электронов, что придает ему положительный заряд. Поскольку каждый атом теперь обладает зарядом, они называются ионами. Два противоположно заряженных иона притягиваются друг к другу, образую ионную связь, которая создает соединение хлорид натрия.
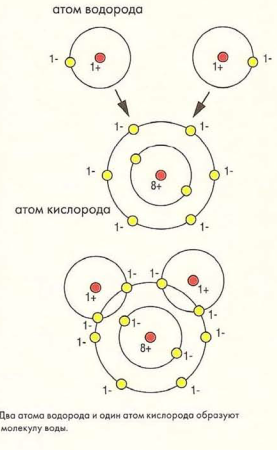
Иногда для завершения внешней орбиты атомы не отдают и не принимают электроны. Вместо этого два или более атомов совместно используют электроны для завершения своих внешних орбит. Такая связь называется ковалентной. Молекула воды является наиболее характерным примером ковалентной связи.
В случае с водой кислород и водород - два элемента, очень легко вступающих в реакцию - объединяются в устойчивое соединение. Чтобы обрести устойчивость, кислороду необходимо два электрона для завершения своей внешней орбиты. У каждого атома водорода есть только один электрон и ему еще нужен один электрон для завершения орбиты. (На ближайшей к ядру орбите могут находиться только два электрона.) Совместно используя электроны, атом кислорода получает два необходимых ему электрона, тогда как каждый из двух атомов водорода получит по одному необходимому ему электрону. Результатом такого пропорционального распределения (два атома водорода на один атом кислорода) является вода, химическое обозначение которой, н3о, является, пожалуй, наиболее известной химической формулой. Именно из-за такой структуры молекулы вода и обладает своими уникальными свойствами, о которых вы узнаете позже.
Дата добавления: 2022-01-31; просмотров: 843;
