Кинетическая теория газов. Законы Бойля-Мариотта и Авогадро
Вещество в природе существует в одном из трех основных состояний: газообразном, жидком или твердом, причем одно и то же вещество в зависимости от температуры и давления может находиться в любом из трех состояний. Например, при обычных температурах вода является жидкостью, но при температуре выше 100°С она превращается в газ (пар), а при температуре ниже 0°С становится твердой (лед).
Все вещества состоят из атомов или молекул, которые в жидкостях и твердых телах удерживаются вместе благодаря межмолекулярным силам притяжения. Молекулы находятся в непрерывном движении, энергия которого зависит от температуры. Межмолекулярные силы, действующие в твердых и жидких телах, ограничивают интенсивность этого «теплового» движения молекул.
Все эти вопросы изучает раздел физики, известной под названием «кинетическая теория» (термин «кинетическая» связан с движением).
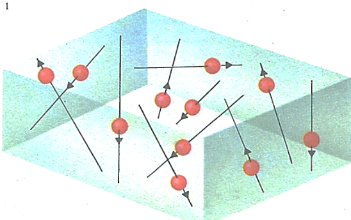
Кинетическая теория газов. В газах преобладает тепловое движение; молекулы газа быстро перемещаются в пространстве, непрерывно сталкиваясь друг с другом и со стенками содержащего их сосуда. Эти столкновения совместно создают давление газа.

Сжатый газ является «хранилищем» потенциальной энергии. При расширении газа до атмосферного давления она может быть использована для совершения полезной работы. Это явление, в частности, применяется в пневматических отбойных молотках
Были произведены различные измерения, подтверждающие справедливость кинетической теории газов. Как известно, при 0°С и давлении 760 мл рт. ст. (так называемые стандартные температура и давление, СТД) 1 л кислорода содержит 3 • 1022 (30000 миллионов миллионов миллионов) молекул. Они движутся со скоростями около 430 м/с. Молекулы чрезвычайно малы, и их размеры измеряются в ангстремах (1 А = 10-10 м): молекуда кислорода составляет примерно 3,5 А в диаметре. Расстояние между молекулами в среднем равно 70 А, а между столкновениями они пробегают около 905 А; это расстояние называется длиной свободного пробега.
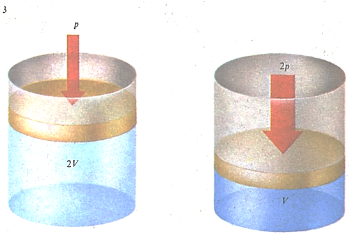
Когда давление, создаваемое поршнем, удваивается, объем газа уменьшается вдвое (если температура не изменяется). Эго следует из закона Бойля - Мариотта, утверждающего, что давление обратно пропорционально объему.
Законы Бойля-Мариотта и Авогадро. С ростом температуры кинетическая энергия молекул (энергия их движения) увеличивается пропорционально абсолютной температуре. В смеси газов средняя кинетическая энергия одинакова для любых видов молекул.
Если газ сжимать при постоянной температуре, то его объем меняется обратно пропорционально давлению. Это соотношение известно как закон Бойля-Мариотта (по имени его первооткрывателей). Подобная зависимость объясняется тем, что при уменьшении объема газа столкновения молекул со стенками сосуда происходят чаще, следовательно, давление растет. Давление увеличивается и при повышении температуры газа (если объем его остается постоянным), поскольку в этом случае столкновения молекул со стенками также происходят чаще и с большей силой.
Другим важным газовым законом является закон Авогадро, открытый итальянским физиком Амедео Авогадро (1776-1856) и названный его именем. Этот закон утверждает, что при равных температурах и давлениях одинаковые объемы идеальных газов содержат равное число молекул. Литр такого плотного газа, как углекислый газ, содержит то же число молекул, что и литр легкого газа-водорода.
Г азы способны медленно диффундировать через стенки пористого сосуда, ибо размеры их молекул меньше мельчайших пор в стенках. Скорость диффузии газа обратно пропорциональна квадратному корню из его плотности. Этот закон был установлен английским физиком Томасом Грэмом (1805—1869) и носит его имя. Данный закон также объясняется кинетической теорией: если молекулы различных газов имеют одинаковую среднюю кинетическую энергию, то легкие молекулы движутся быстрее. Поэтому легкие газы быстрее просачиваются через поры, чем тяжелые.
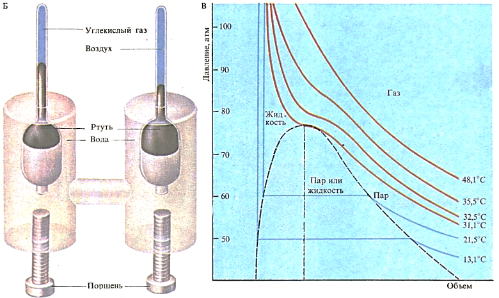
Первоначально для сжижения газов (А) их подвергали воздействию высоких давлений. В некоторых газах при этих условиях устанавливается динамическое равновесие между жидким и газообразным состояниями: молекулы переходят из жидкости в газ и обратно с некоторой средней скоростью. Благодаря исследованиям Томаса Эндрюса были разработаны методы, которые позволили ожижать и другие газы. Давление повышается при завинчивании поршня и передается через воду и воздух в верхние трубки (Б). Поскольку воздух подчиняется закону Бойля-Мариотта, изменение его объема приводит к изменению давления. Графики зависимости давления от объема при постоянной температуре, изотермы (В), отражают различные состояния газа. Горизонтальная голубая линия соответствует процессу сжижения; он начинается, когда температура падает ниже 31, ГС (критическая температура для углекислого газа).
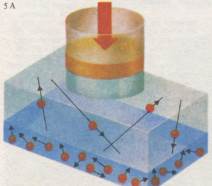
Броуновское движение. Наиболее прямым подтверждением кинетической теории газов служит явление, известное под названием «броуновское движение». Дым сигареты хорошо виден в солнечном луче, пересекающем комнату. Еще более детально мы можем наблюдать этот эффект, если посмотрим через микроскоп на частицы дыма, заключенные в коробке. Мы увидим, что пятнышки света движутся совершенно хаотически: сначала короткий рывок
в одну сторону, потом в другую и т. д. Причина такого движения кроется в неравномерной бомбардировке частиц дыма молекулами воздуха. Более крупные частицы дыма движутся гораздо медленнее, поскольку они и молекулы воздуха имеют в среднем одинаковые кинетические энергии.
Расширяясь, газ совершает работу против внешнего давления. В результате он охлаждается, так как его температура связана с кинетической энергией молекул газа. Именно поэтому охлаждается воздух, выходящий из автомобильной шины. Когда подобное изменение давления или объема газа происходит без поступления или потери тепла, оно называется адиабатическим процессом. Изменение давления при прохождении звуковой волны в воздухе происходит адиабатически.
Количество тепла, необходимое для нагревания единицы массы на 1°С, называется теплоемкостью. Г аз характеризуется двумя различными теплоемкостями: измеренной при постоянном давлении (ср) и при постоянном объеме (сv).
При достаточно сильном сжатии газы превращаются в жидкости. Однако при температурах выше некоторой «критической» сжижение газа посредством одного только увеличения давления оказывается невозможным. Это обусловлено тем, что при таких температурах молекулы газа обладают кинетической энергией, вполне достаточной, чтобы преодолеть межмолекулярное притяжение своих соседей. Поэтому для сжижения газов используют эффект охлаждения при адиабатическом расширении.


На этой диаграмме броуновского движения (А) точки отмечают положения частицы через равные небольшие промежутки времени, а соединяющие их линии показывают пути, пройденные частицей в среднем при ее случайном движении. Луч солнечного света становится видимым благодаря отражению света от частиц дыма (Б). Тот же принцип используется для наблюдения броуновского движения с помощью микроскопа.
Дата добавления: 2022-01-31; просмотров: 791;
